
| A. | 标况下,22.4L SO3含有3NA个O原子 | |
| B. | 常温常压下,27g Al与足量NaOH 溶液反应生成1.5NA个H2 | |
| C. | 常温常压下,32g氧气与臭氧(O3 )的混合物中含有NA个氧原子 | |
| D. | 物质的量浓度为1 mol•L-1 的 K2SO4 溶液中,含2NA个K+ |
分析 A、标况下,三氧化硫为固体;
B、求出铝的物质的量,然后根据1mol铝反应生成1.5mol氢气来分析;
C、氧气与臭氧(O3 )均由氧原子构成;
D、溶液体积不明确.
解答 解:A、标况下,三氧化硫为固体,不能根据气体摩尔体积来计算,故A错误;
B、27g铝的物质的量为1mol,而1mol铝反应生成1.5mol氢气,即1.5NA个氢气分子,故B正确;
C、氧气与臭氧(O3 )均由氧原子构成,则32g混合气体中含有的氧原子的物质的量n=$\frac{32g}{16g/mol}$=2mol,即2NA个氧原子,故C错误;
D、溶液体积不明确,故溶液中钾离子的个数无法计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
| 物质名称及化学式 | 氯化亚铜CuCl | 碱式氯化铜Cu2(OH)3Cl |
| 性质 | 白色固体、不溶水 | 绿色固体、不溶水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | ||
| C. |  | D. | 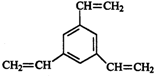 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由①知,氢气的燃烧热为241.8 kJ | |
| B. | 由①、②知,2H2S(g)+O2(g)=2S(g)+2H2O(g)△H=-443.4kJ/mol | |
| C. | 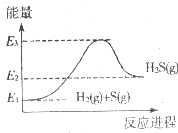 反应②中的能量变化可用如图表示 | |
| D. | 若反应②中改用固态硫,则放热大于20.1 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
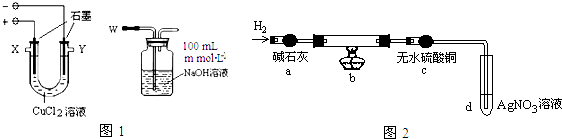
 ;若Y为化合物,用石墨电极电解Y的水溶液,其电解反应为2HCl$\frac{\underline{\;电解\;}}{\;}$H2↑+C12↑.
;若Y为化合物,用石墨电极电解Y的水溶液,其电解反应为2HCl$\frac{\underline{\;电解\;}}{\;}$H2↑+C12↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | ||
| Y | Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径Na<Mg<Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 碱性:KOH>NaOH>Mg(OH)2 | D. | 酸性强弱:H2SiO3<H2CO3<H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使澄清石灰水变浑浊的气体一定是CO2 | |
| B. | 能使品红溶液褪色,将其煮沸又变红的无色气体为SO2 | |
| C. | 与浓H2SO4反应可产生SO2的一定是亚硫酸的正盐 | |
| D. | 某酸性溶液经分析含大量S2-,SO42-,MnO4- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com