
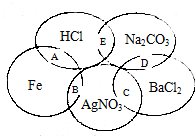
 如图图为一五元环图案,小明在图案上依次写了五种物质,图中相交的两种物质均可发生化学反应,A、B、C、D、E表示其相应的化学反应.请回答下列问题:
如图图为一五元环图案,小明在图案上依次写了五种物质,图中相交的两种物质均可发生化学反应,A、B、C、D、E表示其相应的化学反应.请回答下列问题:分析 (1)反应中存在元素化合价的变化的反应为氧化还原反应;
(2)根据氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性判断.
解答 解:(1)A反应为Fe与HCl反应,Fe、H元素的化合价发生变化,属于氧化还原反应;
B反应为Fe与硝酸银的置换反应,Fe、Ag元素的化合价发生变化,属于氧化还原反应;
C反应为氯化钡与硝酸银之间的复分解反应,不是氧化还原反应;
D反应为氯化钡与碳酸钠之间的复分解反应,不是氧化还原反应;
E反应为HCl与碳酸钠之间的复分解反应,不是氧化还原反应;
所以属于非氧化还原反应的是CDE;
故答案为:CDE;
(2)金属活动顺序表中Ag排在H的后面,则氧化性:Ag+>H+,Fe与HCl反应生成氢气和氯化亚铁,则氧化性:H+>Fe2+;所以氧化性:Ag+>H+>Fe2+;
故答案为:Ag+>H+>Fe2+.
点评 本题考查氧化还原反应,侧重于学生的分析能力的考查,注意把握氧化还原反应的特征,从元素化合价的角度认识相关概念和物质的性质,难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 被氧化元素与被还原元素的质量比为1:1 | |
| B. | NaBH4是氧化剂,H2O是还原剂 | |
| C. | 硼元素被氧化,氢元素被还原 | |
| D. | NaBH4既是氧化剂,又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
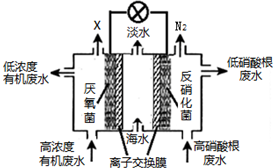
| A. | 中间室Cl-移向左室 | |
| B. | X气体为CO2 | |
| C. | 处理后的含硝酸根废水pH降低 | |
| D. | 电路中每通过4 mol电子,产生标准状况下X的体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何化学反应都伴随着能量变化 | |
| B. | 化学反应中的能量变化都表现为热量变化 | |
| C. | 化学反应会引起化学键的变化 | |
| D. | 反应物的总能量低于生成物的总能量时,发生吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用标准盐酸滴定待测氢氧化钠溶液至终点,读数时视线偏高 | |
| B. | 用含Na2O的NaOH固体配制成的标准溶液,滴定待测盐酸 | |
| C. | 将4.0g NaOH溶解后迅速转移入1L的容量瓶中定容,配制0.1moL/L的NaOH溶液 | |
| D. | 将1mL 98%的浓硫酸加入9mL水中,配制9.8%的稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:10:100 | B. | 0:1:12 | C. | 14:13:12 | D. | 14:13:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片.观察:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面.以下有关解释合理的是( )
如图小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片.观察:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面.以下有关解释合理的是( )| A. | 生铁片中的碳是原电池的阳极,发生还原反应 | |
| B. | 墨水回升时,生铁片发生吸氧腐蚀 | |
| C. | 雨水酸性较强,生铁片仅发生析氢腐蚀 | |
| D. | 具支试管中溶液pH逐渐减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com