
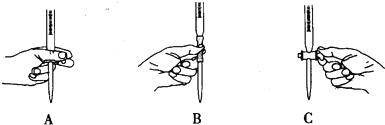
·ÖĪö £Ø1£©øßĆĢĖį¼ŲæÉŃõ»ÆĀČĄė×Ó£¬ĻõĖįæÉŃõ»ÆŃĒĢśĄė×Ó£¬æÉŃ”ŌńĮņĖįĖį»Æ£»
£Ø2£©øßĆĢĖį¼Ų¾ßÓŠĒæŃõ»ÆŠŌ£¬æÉŃõ»ÆĻš½ŗ£¬Ń”ŌńĖįŹ½µĪ¶Ø¹Ü£¬×óŹÖæŲÖĘ»īČū£»
£Ø3£©½įŗĻ5Fe2++8H++MnO4-ØT5Fe3++Mn2++4H2O¼ĘĖć£®
½ā“š ½ā£ŗ£Ø1£©øßĆĢĖį¼ŲæÉŃõ»ÆĀČĄė×Ó£¬ĻõĖįæÉŃõ»ÆŃĒĢśĄė×Ó£¬ŹŌ¼Į2ĪŖĖį£¬æÉĪŖĮņĖį£¬¹Ź“š°øĪŖ£ŗC£»
£Ø2£©øßĆĢĖį¼Ų¾ßÓŠĒæŃõ»ÆŠŌ£¬æÉŃõ»ÆĻš½ŗ£¬Ń”ŌńĖįŹ½µĪ¶Ø¹Ü£¬×óŹÖæŲÖĘ»īČū£¬Ö»ÓŠA·ūŗĻ£¬¹Ź“š°øĪŖ£ŗA£»
£Ø3£©·¢Éś5Fe2++8H++MnO4-ØT5Fe3++Mn2++4H2O£¬n£ØFe2+£©=0.020 0 mol/L”Į12.00”Į10-3 L”Į5”Į$\frac{1000mL}{20.00mL}$=0.060 0mol£¬m£ØFe2+£©=0.0600 mol”Į56 g/mol=3.36g£¬ŗ¬”°Ģś”±ĮæĪŖ£ŗ$\frac{3.36g}{10.0g}$”Į100%=33.6%£¬
¹Ź“š°øĪŖ£ŗ33.6%£®
µćĘĄ ±¾Ģāæ¼²éĪļÖŹŗ¬ĮæµÄ²ā¶Ø£¬ĪŖøßĘµæ¼µć£¬°ŃĪÕĪļÖŹµÄŠŌÖŹ”¢µĪ¶Ø²Ł×÷”¢ŅĒĘ÷µÄŹ¹ÓĆ”¢½įŗĻ·“Ó¦µÄ¼ĘĖćĪŖ½ā“šµÄ¹Ų¼ü£¬²ąÖŲ·ÖĪöÓėŹµŃéÄÜĮ¦µÄ漲飬עŅāŃõ»Æ»¹Ō·“Ó¦ŌŚŹµŃéÖŠµÄÓ¦ÓĆ£¬ĢāÄæÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ½ŗĢåĒų±šÓŚĘäĖü·ÖÉ¢ĻµµÄ±¾ÖŹĢŲÕ÷ŹĒ£ŗ½ŗĢåĮ£×ÓÖ±¾¶ŌŚ1-100nmÖ®¼ä | |
| B£® | Ņ»¶ØĪĀ¶Č”¢Ń¹ĒæĻĀ£¬ĘųĢåĢå»żÓÉĘä·Ö×ӵē󊔾ö¶Ø | |
| C£® | Ńõ»Æ»¹Ō·“Ó¦µÄ±¾ÖŹŹĒµē×Ó×ŖŅĘ | |
| D£® | ŌŚ1L2mol/LµÄĒāŃõ»ÆĢś½ŗĢåÖŠŗ¬ÓŠĒāŃõ»ÆĢś½ŗĮ£ŹżŠ”ÓŚ2NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ±ź×¼×“æöĻĀ£¬22.4 L ĖÄĀČ»ÆĢ¼£ØCCl4£©ŗ¬ÓŠµÄĢ¼Ō×ÓŹżÄæĪŖNA | |
| B£® | CO2ĶعżNa2O2Ź¹ĘäŌöÖŲ5.6gŹ±£¬·“Ó¦ÖŠ×ŖŅʵĵē×ÓŹżĪŖ0.4 NA | |
| C£® | 0.2mol FeÓė0.2 mol Cl2·“Ó¦Ź±Ź§µē×ÓŹżĪŖ0.6NA | |
| D£® | ³£ĪĀ³£Ń¹ĻĀ£¬29.8 g KClÓėNaClOµÄ¹ĢĢå»ģŗĻĪļÖŠŅõĄė×ӵďżÄæĪŖ0.4 NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
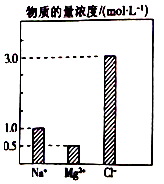 ŌŚ0.2LÓÉNaCl”¢MgCl2”¢BaCl2×é³ÉµÄ»ģŗĻČÜŅŗÖŠ£¬²æ·ÖĄė×ÓÅØ¶Č“óŠ”ČēĶ¼ĖłŹ¾£¬¶ŌÓŚøĆČÜŅŗ³É·Ö£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©
ŌŚ0.2LÓÉNaCl”¢MgCl2”¢BaCl2×é³ÉµÄ»ģŗĻČÜŅŗÖŠ£¬²æ·ÖĄė×ÓÅØ¶Č“óŠ”ČēĶ¼ĖłŹ¾£¬¶ŌÓŚøĆČÜŅŗ³É·Ö£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©| A£® | NaClµÄĪļÖŹµÄĮæĪŖ0.2mol | |
| B£® | ČÜÖŹMgCl2µÄÖŹĮæĪŖ9 g | |
| C£® | øĆ»ģŗĻŅŗÖŠBaCl2µÄĪļÖŹµÄĮæĪŖ0.1mol | |
| D£® | ½«øĆ»ģŗĻŅŗ¼ÓĖ®Ļ”ŹĶÖĮĢå»żĪŖ1 L£¬Ļ”ŹĶŗóČÜŅŗÖŠµÄBa2+ĪļÖŹµÄĮæÅضČĪŖ0.1mol/L |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
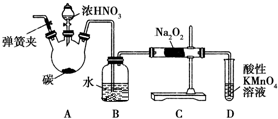 ŃĒĻõĖįÄĘ£ØNaNO2£©±»³ĘĪŖ¹¤ŅµŃĪ£¬ŌŚĘÆ°×”¢µē¶ĘµČ·½ĆęÓ¦ÓĆ¹ć·ŗ£®ŅŌľĢ攢ÅØĻõĖį”¢Ė®ŗĶĶĪŖŌĮĻÖʱøŃĒĻõĖįÄʵÄ×°ÖĆČēĶ¼ĖłŹ¾£®ŅŃÖŖ£ŗŹŅĪĀĻĀ£¬¢Ł2NO+Na2O2ØT2NaNO2£»¢Ś3NaNO2+3HClØT3NaCl+HNO3+2NO”ü+H2O£»¢ŪĖįŠŌĢõ¼žĻĀ£¬NO»ņNO2-¶¼ÄÜÓėMnO4-·“Ӧɜ³ÉNO3-ŗĶMn2+£®
ŃĒĻõĖįÄĘ£ØNaNO2£©±»³ĘĪŖ¹¤ŅµŃĪ£¬ŌŚĘÆ°×”¢µē¶ĘµČ·½ĆęÓ¦ÓĆ¹ć·ŗ£®ŅŌľĢ攢ÅØĻõĖį”¢Ė®ŗĶĶĪŖŌĮĻÖʱøŃĒĻõĖįÄʵÄ×°ÖĆČēĶ¼ĖłŹ¾£®ŅŃÖŖ£ŗŹŅĪĀĻĀ£¬¢Ł2NO+Na2O2ØT2NaNO2£»¢Ś3NaNO2+3HClØT3NaCl+HNO3+2NO”ü+H2O£»¢ŪĖįŠŌĢõ¼žĻĀ£¬NO»ņNO2-¶¼ÄÜÓėMnO4-·“Ӧɜ³ÉNO3-ŗĶMn2+£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
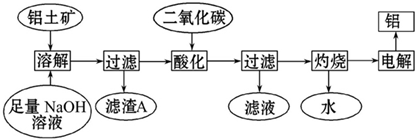
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
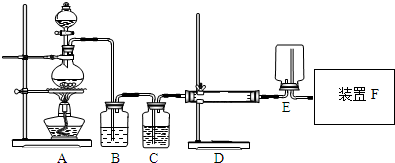

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
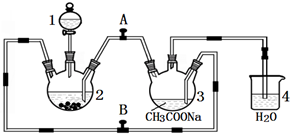 ¶ž¼Ūøõ²»ĪČ¶Ø£¬¼«Ņ×±»ŃõĘųŃõ»Æ£®“×ĖįŃĒøõĖ®ŗĻĪļ{[Cr£ØCH3COO£©2]2•2H2O£¬Ļą¶Ō·Ö×ÓÖŹĮæĪŖ376}ŹĒŅ»ÖÖÉīŗģÉ«¾§Ģ壬²»ČÜÓŚĄäĖ®ŗĶĆŃ£¬Ņ×ČÜÓŚŃĪĖį£¬ŹĒ³£ÓƵÄŃõĘųĪüŹÕ¼Į£®ŹµŃéŹŅÖŠŅŌŠæĮ£”¢CrCl3ČÜŅŗ”¢“×ĖįÄĘČÜŅŗŗĶŃĪĖįĪŖÖ÷ŅŖŌĮĻÖʱø“×ĖįŃĒøõĖ®ŗĻĪļ£¬Ęä×°ÖĆČēĶ¼ĖłŹ¾£ŗ
¶ž¼Ūøõ²»ĪČ¶Ø£¬¼«Ņ×±»ŃõĘųŃõ»Æ£®“×ĖįŃĒøõĖ®ŗĻĪļ{[Cr£ØCH3COO£©2]2•2H2O£¬Ļą¶Ō·Ö×ÓÖŹĮæĪŖ376}ŹĒŅ»ÖÖÉīŗģÉ«¾§Ģ壬²»ČÜÓŚĄäĖ®ŗĶĆŃ£¬Ņ×ČÜÓŚŃĪĖį£¬ŹĒ³£ÓƵÄŃõĘųĪüŹÕ¼Į£®ŹµŃéŹŅÖŠŅŌŠæĮ£”¢CrCl3ČÜŅŗ”¢“×ĖįÄĘČÜŅŗŗĶŃĪĖįĪŖÖ÷ŅŖŌĮĻÖʱø“×ĖįŃĒøõĖ®ŗĻĪļ£¬Ęä×°ÖĆČēĶ¼ĖłŹ¾£ŗ²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com