
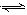 2C(g)+Q达到平衡后,将气体混合物的温度降低,下列叙述中正确的是?摇()。
2C(g)+Q达到平衡后,将气体混合物的温度降低,下列叙述中正确的是?摇()。 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| c2(CO) |
| c(CO2) |
| c2(CO) |
| c(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种.且均符合勒夏特列原理.请回答下列问题.
化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种.且均符合勒夏特列原理.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,可逆反应A(g)+3(B)(g)![]() 2C(g)达到平衡的标志是( )
2C(g)达到平衡的标志是( )
A.C生成的速率与C分解的速率相等 B.A、B、C的浓度不再变化
C.单位时间生成n mol A,同时生成3n mol B D.A、B、C的分子数之比为1∶3∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com