
(1)在下列反应中:
| A.2F2+2H2O=4HF+O2↑; | B.2Na+2H2O=2NaOH +H2↑; | C.CaO+H2O=Ca(OH)2; | D.2H2O 2H2↑+O2↑。其中(填序号): 2H2↑+O2↑。其中(填序号): |
(1)B A D C
(2)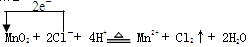 5.6
5.6
解析试题分析:(1)反应2Na+2H2O=2NaOH+H2↑中,水中氢元素化合价降低,只作氧化剂,反应2F2+2H2O=4HF+O2中,水中氧元素化合价升高,水只作还原剂,反应2H2O2 H2↑+O2↑中,水中的氢元素化合价降低,氧元素化合价升高,所以水既作氧化剂又作还原剂,反应CaO+H2O=Ca(OH)2中,水中的氢元素和氧元素化合价均未变化,所以水既作氧化剂又作还原剂;(2)瑞典科家舍勒在研究软锰矿(主要成份为MnO2)时,将浓盐酸与软锰矿混合加热,产生了一种有刺激性气味的有色气体,是二氧化锰和浓盐酸加热反应生成氯化锰,氯气和水;反应的化学方程式为:4HCl+MnO2
H2↑+O2↑中,水中的氢元素化合价降低,氧元素化合价升高,所以水既作氧化剂又作还原剂,反应CaO+H2O=Ca(OH)2中,水中的氢元素和氧元素化合价均未变化,所以水既作氧化剂又作还原剂;(2)瑞典科家舍勒在研究软锰矿(主要成份为MnO2)时,将浓盐酸与软锰矿混合加热,产生了一种有刺激性气味的有色气体,是二氧化锰和浓盐酸加热反应生成氯化锰,氯气和水;反应的化学方程式为:4HCl+MnO2 MnCl2+Cl2↑+2H2O,反应中锰元素化合价从+4价变化为+2价,转移电子数为2e-;标注电子转移的化学方程式为:
MnCl2+Cl2↑+2H2O,反应中锰元素化合价从+4价变化为+2价,转移电子数为2e-;标注电子转移的化学方程式为: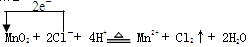 ,故电子转移的数目为3.01×1023个即转移0.5mol电子时,生成的氯气在标准状况时的体积为0.5mol/2mol×22.4mol/L=5.6L。
,故电子转移的数目为3.01×1023个即转移0.5mol电子时,生成的氯气在标准状况时的体积为0.5mol/2mol×22.4mol/L=5.6L。
考点:氧化还原反应。


科目:高中化学 来源: 题型:填空题
已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是________,被氧化的离子的物质的量分别是________________。
(2)如果向原溶液中通入3 mol Cl2,则被氧化的离子是________,其对应氧化产物的物质的量分别是________________。
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82—+2I-=2SO42—+I2。通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应的催化过程:______________________________、____________________________(不必配平)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在50 mL a mol·L-1的硝酸溶液中,加入6.4 g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100 mL时测得c(NO3-)=3 mol·L-1。
(1)稀释后的溶液pH= ;
(2)若a=9,则生成的气体中NO2的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫酸厂用煅烧黄铁矿(FeS2)制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2制备绿矾。
(一)SO2和O2反应制取的反应原理为:2SO2+O2 2SO3,在一密闭容器中一定时间内达到平衡。
2SO3,在一密闭容器中一定时间内达到平衡。
(1)该反应的平衡常数表达式为______。
(2)该反应达到平衡状态的标志是______。
| A.v(SO2)=v(SO3) | B.混合物的平均相对分子质量不变 |
| C.混合气体质量不变 | D.各组分的体积分数不变 |


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 Fe3O4+6SO2,有3mol FeS2参加反应,转移 mol电子。
Fe3O4+6SO2,有3mol FeS2参加反应,转移 mol电子。
(2)FeCl3溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为 ;从腐蚀废液回收得到金属铜,还需要的试剂是 。
(3)与明矾相似,Fe2(SO4)3也可用作净水剂,在使用时发现Fe2(SO4)3并不能使酸性废水中的悬浮物沉降除去,其原因是 。
(4)钢铁的电化学腐蚀简单示意图如下,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在下图虚线框中作出修改,并用箭头标出电子流动的方向。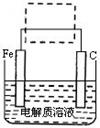
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
肼(N2H4)是火箭发射常用的燃料。
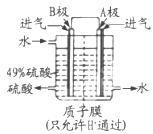
(1)最新实验研究用肼还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。请写出该制法的化学反应方程式____________________________,当反应中转移0.2 mol电子 时,可制得Cu2O的质量为__________。
(2)一种以肼(N2H4)为燃料的电池装置如图所示。该燃料电池的电极材料采用多孔导电材料,以提高电极反应物在电极表面的吸附量,并使它们与电解质溶液充分接触,以空气中的氧气作为氧化剂,KOH溶液作为电解质。负极上发生的电极反应为_________________; ②电池工作时产生的电流从_______电极经过负载后流向________电极(填“左侧”或“右侧”)。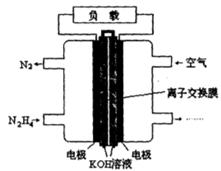
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路,发生反应的化学方程式为: ①取少量废液,滴加KSCN溶液显红色.②取10mL废液,加入足量的AgNO3溶液,析出沉淀8.61g.③另取10mL废液,加入一定质量的铜片,充分反应后,测得铜片的质量减少了0.256g,再向反应后的溶液中滴加KSCN溶液不变色.根据探究实验得出结论:
(1)废液中含有的金属离子是 。
(2)求10mL废液中氯离子的物质的量浓度?
(3)求10mL废液中铜离子的物质的量是 ?
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO2-4等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号
(2)工业生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。选择适宜的催化剂,是否可以提高SO2的转化率? (填“是”或“否”),是否可以增大该反应所放出的热量? (填“是”或“否”);
(3)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦碳在高温的氮气流中,通过以下反应制得: SiO2 + C + N2 = Si3N4 + CO)
①配平上述反应的化学方程式
②该反应的平衡常数表达式为K=
(4)水是一种重要的自然资源,天然水在净化处理过程中加入的混凝剂可以是 __ (填两种物质名称),其净水作用的原理是
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氯气在生产生活中应用广泛。实验室可用MnO2与浓盐酸反应制取,反应原理如下:MnO2+4HCl(浓)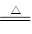 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)若制得标准状况下11.2 L Cl2,则被氧化的HCl为___________mol。
(2)多余的氯气可用NaOH溶液吸收,反应的离子方程式为__________。
(3)海底蕴藏着丰富的锰结核矿,其主要成分是MnO2。1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如下图所示:
①步骤Ⅰ中, 试剂甲必须具有的性质是____________(填序号)。
A.氧化性B.还原性C.酸性
②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050 mol MnO2时,消耗0.10 mol·L-1的NaClO3溶液200 mL,该反应的离子方程式为___________________________。
(4)用100mL12.0 mol·L-1的浓盐酸与足量MnO2混合后,加热,反应产生的氯气物质的量远远少于0.30 mol,请你分析可能的原因为___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com