
ЁОЬтФПЁПЃЈ1ЃЉТШЦјЕФЪЕбщЪвжЦЗЈЕФЛЏбЇЗНГЬЪНЮЊ________ЁЃШчЭМЫљЪОЃЌНЋТШЦјвРДЮЭЈЙ§ЪЂгаИЩдягаЩЋВМЬѕЕФЙуПкЦПAКЭЪЂгаГБЪЊгаЩЋВМЬѕЕФЙуПкЦПBЃЌПЩЙлВьЕНЕФЯжЯѓЪЧ______ЁЃ
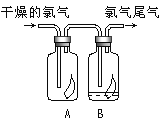
ЃЈ2ЃЉЙЄвЕЩЯГЃгУСЎМлЕФЪЏЛвШщЮќЪеЙЄвЕТШЦјЮВЦјжЦЕУЦЏАзЗлЃЌГЄЦкТЖжУгкПеЦјжаЕФЦЏАзЗлЃЌМгЯЁбЮЫсКѓВњЩњЕФЦјЬхЪЧ_________ЃЈгУзжФИДњКХЬюЃЉЁЃ
AЃЎO2 BЃЎCl2 CЃЎCO2 DЃЎHClO
ЃЈ3ЃЉЪЕбщЪвгУШчЭМЫљЪОзАжУжЦШЁАБЦјЃЌЪеМЏАБЦјгІЪЙгУ___ЗЈЃЛМгШШКѓНЋеКгаХЈбЮЫсЕФВЃСЇАєППНќЕМЙмПк,ВњЩњЕФЯжЯѓЪЧ________ЃЌвЊЕУЕНИЩдяЕФАБЦјПЩбЁгУ___зіИЩдяМСЃЌГ§АБЦјЭтЛЙПЩвдгУИУзАжУжЦШЁЕФГЃМћЦјЬхЪЧ_______ЁЃ
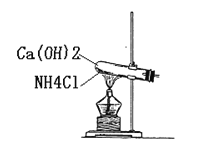
ЁОД№АИЁПMnO2+4HCl(ХЈ)![]() MnCl2+Cl2+2H2O ИЩдягаЩЋВМЬѕЮоУїЯдЯжЯѓЃЌГБЪЊгаЩЋВМЬѕЭЪЩЋ C ЯђЯТХХПеЦј ВњЩњАзбЬ МюЪЏЛв бѕЦј
MnCl2+Cl2+2H2O ИЩдягаЩЋВМЬѕЮоУїЯдЯжЯѓЃЌГБЪЊгаЩЋВМЬѕЭЪЩЋ C ЯђЯТХХПеЦј ВњЩњАзбЬ МюЪЏЛв бѕЦј
ЁОНтЮіЁП
ЃЈ1ЃЉЪЕбщЪвжЦБИТШЦјЃЌГЃгУMnO2КЭХЈбЮЫсЗДгІЃЌМДЗДгІЗНГЬЪНЮЊMnO2ЃЋ4HCl(ХЈ) ![]() MnCl2ЃЋCl2ЁќЃЋ2H2OЃЛИЩдяЕФТШЦјВЛФмЪЙИЩдяЕФгаЩЋВМЬѕЭЪЩЋЃЌФмЪЙЪЊШѓЕФгаЩЋВМЬѕЭЪЩЋЃЛ
MnCl2ЃЋCl2ЁќЃЋ2H2OЃЛИЩдяЕФТШЦјВЛФмЪЙИЩдяЕФгаЩЋВМЬѕЭЪЩЋЃЌФмЪЙЪЊШѓЕФгаЩЋВМЬѕЭЪЩЋЃЛ
Д№АИЮЊMnO2ЃЋ4HCl(ХЈ) ![]() MnCl2ЃЋCl2ЁќЃЋ2H2OЃЛИЩдягаЩЋВМЬѕЮоУїЯдЯжЯѓЃЌГБЪЊгаЩЋВМЬѕЭЪЩЋЃЛ
MnCl2ЃЋCl2ЁќЃЋ2H2OЃЛИЩдягаЩЋВМЬѕЮоУїЯдЯжЯѓЃЌГБЪЊгаЩЋВМЬѕЭЪЩЋЃЛ
ЃЈ2ЃЉЦЏАзЗлЕФГЩЗжЪЧCaCl2КЭCa(ClO)2ЃЌгааЇГЩЗжЪЧCa(ClO)2ЃЌвђЮЊЬМЫсЕФЫсадЧПгкHClOЃЌЦЏАзЗлГЄЦкЗХжУдкПеЦјЃЌЗЂЩњCa(ClO)2ЃЋCO2ЃЋH2O=CaCO3Ё§ЃЋ2HClOЃЌHClOМћЙтЗжНтГЩЮЊHClКЭO2ЃЌМгШыбЮЫсКѓЃЌЗЂЩњCaCO3ЃЋ2HCl=CaCl2ЃЋCO2ЁќЃЋH2OЃЌВњЩњЕФЦјЬхЮЊCO2ЃЌбЁЯюCе§ШЗЃЛ
Д№АИЮЊCЃЛ
ЃЈ3ЃЉвђЮЊАБЦјМЋвзШмгкЫЎЃЌвђДЫВЩгУХХПеЦјЗЈЪеМЏЃЌАБЦјЕФУмЖШаЁгкПеЦјЃЌВЩгУЯђЯТХХПеЦјЗЈЪеМЏЃЛХЈбЮЫсОпгаЛгЗЂадЃЌСНепЗЂЩњNH3ЃЋHCl=NH4ClЃЌNH4ClЮЊЙЬЬхЃЌМДЯжЯѓЪЧВњЩњАзбЬЃЛЪЕбщЪвИЩдяАБЦјГЃВЩгУМюЪЏЛвЃЛИУзАжУЮЊЙЬЬхЃЋЙЬЬх![]() ЦјЬхЃЌПЩвдРћгУИУзАжУжЦБИбѕЦјЃЛ
ЦјЬхЃЌПЩвдРћгУИУзАжУжЦБИбѕЦјЃЛ
Д№АИЮЊЯђЯТХХПеЦјЃЛВњЩњАзбЬЃЛМюЪЏЛвЃЛбѕЦјЁЃ


 КЎМйДѓДЎСЊЛЦЩНЪщЩчЯЕСаД№АИ
КЎМйДѓДЎСЊЛЦЩНЪщЩчЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПAЁЂBЁЂCЁЂDЁЂEЮхжжЛЏКЯЮя ЃЌОљКЌгаФГжжГЃМћН№ЪєдЊЫиЃЌЫќУЧЕФзЊЛЏЙиЯЕШчЭМЫљЪОЃЌЦфжаAЮЊГЮЧхШмвКЃЌCЮЊФбШмЕФАзЩЋЙЬЬхЃЌEдђвзШмгкЫЎЃЌШєШЁAШмвКзЦЩеЃЌбцЩЋЗДгІЮЊзЯЩЋЃЈЭИЙ§РЖЩЋюмВЃСЇЙлВьЃЉЁЃ

ЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉаДГіЛЏбЇЪНЃКB____________ЃЌD___________ЁЃ
ЃЈ2ЃЉЮхжжЛЏКЯЮяжаФбШмгкЫЎЕФЪЧ___________________ЃЈЬюЛЏбЇЪНЃЉЁЃ
ЃЈ3ЃЉаДГіЯТСаЗДгІЕФРызгЗНГЬЪНЃК
AЁњBЃК_________________________________________________ЁЃ
BЁњEЃК_________________________________________________ЁЃ
CЁњEЃК_________________________________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШчЭМЪЧСђЫсЪдМСЦПБъЧЉЩЯЕФФкШнЃК

ЃЈ1ЃЉФГЛЏбЇаЫШЄаЁзщНјааСђЫсаджЪЕФЪЕбщЬНОПЪБЃЌашвЊ490mL0.92molЁЄL-1ЕФЯЁСђЫсЃЌЯжвЊХфжЦИУХЈЖШЕФШмвКЫљашЕФВЃСЇвЧЦїГ§СПЭВЁЂЩеБЁЂВЃСЇАєЁЂНКЭЗЕЮЙмЭтЃЌЛЙашвЊ__ЃЈЬювЧЦїУћГЦЃЉЃЛашвЊСПШЁ98%ХЈСђЫс__mLНјааХфжЦЃЛ
ЃЈ2ЃЉХфжЦШмвКЪБгаШчЯТВйзїЃКa.ЯЁЪЭШмНтb.вЁдШc.ЯДЕгd.РфШДe.СПШЁf.НЋШмвКвЦжСШнСПЦПg.ЖЈШнЃЌЪЕбщВйзїЫГађе§ШЗЕФЪЧЃЈ_____ЃЉ
A.eЁњaЁњfЁњdЁњcЁњfЁњgЁњb B.eЁњaЁњdЁњfЁњcЁњfЁњgЁњb
C.eЁњaЁњfЁњdЁњcЁњfЁњbЁњg D.eЁњaЁњdЁњfЁњcЁњfЁњbЁњg
ЃЈ3ЃЉдкХфжЦ0.92molЁЄL-1ЯЁСђЫсЕФЙ§ГЬжаЃЌЯТСаЧщПіЛсв§Ц№ХфжЦЫљЕУЕФСђЫсШмвКЮяжЪЕФСПХЈЖШЦЋЕЭЕФЪЧ__ЃЛ
A.ЮДОРфШДГУШШНЋШмвКзЂШыШнСПЦПжа B.СПШЁХЈСђЫсЪБбіЪгЖСЪ§
C.ЖЈШнЪБИЉЪгЙлВьвКУц D.ЮДЯДЕгЩеБКЭВЃСЇАє
ЃЈ4ЃЉЮЊжаКЭ100mL2.3molЁЄL-1KOHШмвКЪЙЦфЧЁКУЭъШЋЗДгІЃЌашвЊМгШы__mL0.92molЁЄL-1ЯЁСђЫсЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПДгМзБНГіЗЂЃЌАДЯТУцСїГЬПЩвдКЯГЩБНМзЫсБНМзѕЅКЭЫЎбюЫсЁЃ
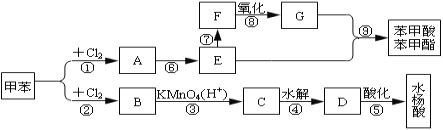
вбжЊЫЎбюЫсЕФНсЙЙМђЪНЮЊ![]() ЧвЗгєЧЛљвзБЛбѕЛЏЁЃЧыЛиД№ЃК
ЧвЗгєЧЛљвзБЛбѕЛЏЁЃЧыЛиД№ЃК
ЃЈ1ЃЉаДГіЯТСаЗДгІЕФЬѕМўЃКЂй_____________ЁЂЂк_______ЃЛ
ЃЈ2ЃЉCЁЂFЕФНсЙЙМђЪНЗжБ№ЮЊЃКC___ЁЂF___ЃЛ
ЃЈ3ЃЉаДГіЗДгІЂоЁЂЂсЕФЛЏбЇЗНГЬЪНЃКЂо________________Ђс_____
ЃЈ4ЃЉаДГіЗДгІРраЭЃКЂк____________ Ђо____________ Ђс______________
ЃЈ5ЃЉЂлЁЂЂмСНВНЗДгІФмЗёЛЅЛЛЃЌЮЊЪВУДЃП___ЁЃ
ЃЈ6ЃЉаДГіЫЎбюЫсЕФЭЌЗжвьЙЙЬхжаЪєгкѕЅЕФНсЙЙМђЪН_______________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгУКЌЩщбѕЛЏЭПѓ[КЌCuOЁЂCu2(OH)2CO3ЁЂAs2O3МАжиН№ЪєбЮЕШ]жЦШЁCu2(OH)2SO4ЕФЙЄвеСїГЬШчЯТЃК
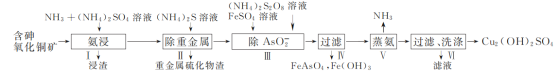
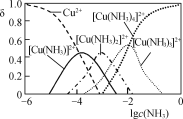
(1) ВНжшЂёЁААБНўЁБЪБЃЌПижЦЮТЖШЮЊ50ЁЋ55 ЁцЃЌpHдМЮЊ9.5ЃЌКЌЭЛЏКЯЮязЊЛЏЮЊ[Cu(NH3)4]SO4ШмвКЁЃ
Ђй CuOБЛНўШЁЕФРызгЗНГЬЪНЮЊ________ЁЃ
ЂкНўШЁЮТЖШВЛвЫГЌЙ§55 ЁцЃЌЦфдвђЪЧ________ЁЃ
Ђл Cu2ЃЋгыNH3НсКЯЪБЃЌШмвКжаКЌЭЮЂСЃЕФЮяжЪЕФСПЗжВМЗжЪ§(ІФ)гыШмвКжагЮРыЕФc(NH3)ЕФЖдЪ§жЕЕФЙиЯЕШчЭМЫљЪОЁЃШєгУ1 LНўШЁвК(гЩЕШЮяжЪЕФСПNH3КЭNH4+зщГЩ)НЋamolCu2(OH)2CO3ШЋВПНўГіЮЊ[Cu(NH3)4]2ЃЋ(CO32-зЊБфЮЊHCO3-ЃЌВЛПМТЧЦфЫћЗДгІЃЌШмвКЬхЛ§БфЛЏКіТдВЛМЦ)ЃЌдНўШЁвКжаЦ№ЪМЪБc(NH3)гІТњзуЕФЬѕМўЪЧ________ЁЃ
(2) ЁАГ§AsO2-ЁБЪБЃЌFeSO4ашЙ§СПЃЌвЛЗНУцЪЙAsO2-ГСЕэЭъШЋЃЌСэвЛФПЕФЪЧ________ЁЃ
(3) ЁАеєАБЁБЪБЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ________ЁЃ
(4) ЮЊСЫЪЕЯжЩњВњЙ§ГЬжаЮяжЪбЛЗРћгУЃЌПЩВЩШЁЕФДыЪЉЮЊ________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A.ГЃЮТЯТЃЌЗДгІNH3(g)+HCl(g)=NH4Cl(s)ФмздЗЂЗЂЩњЗДгІЃЌдђИУЗДгІЕФЁїH>0
B.ГЃЮТЯТЃЌЕШЮяжЪЕФСПХЈЖШЕФCH3COOHШмвККЭHClШмвКжаЃЌЫЎЕФЕчРыГЬЖШЯрЭЌ
C.ГЃЮТЯТЃЌ0.1molLЉ1CH3COONaШмвКМгЫЎЯЁЪЭКѓЃЌШмвКжа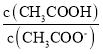 ЕФжЕдіДѓ
ЕФжЕдіДѓ
D.ГЃЮТЯТЃЌЯђBaCO3ЁЂBaSO4ЕФБЅКЭШмвКжаМгШыЩйСПBaCl2ЙЬЬхЃЌШмвКжа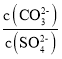 МѕаЁ
МѕаЁ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгааЇШЅГ§ЗЯЫЎжаЕФH2SiF6ЁЂF-ЃЌИФЩЦЫЎжЪЪЧЛЗОГВПУХЕФживЊбаОППЮЬтЁЃ
ЃЈ1ЃЉAlF3ЪЧгаЛњКЯГЩжаГЃгУДпЛЏМСЃЌРћгУЗЯЫЎжаЕФH2SiF6ПЩзЊБфжЦЕУЃЌЯрЙиЕФШШЛЏбЇЗНГЬЪНШчЯТЃК
3H2SiF6(aq)+2Al(OH)3(s)=Al2(SiF6)3(aq)+6H2O(l)ЃЛІЄH=akJЁЄmol-1
Al2(SiF6)3(aq)+6H2O(l)=2AlF3(aq)+3SiO2(s)+12HF(aq)ЃЛІЄH=bkJЁЄmol-1
3HF(aq)+Al(OH)3(s)=AlF3(aq)+3H2O(l)ЃЛІЄH=ckJЁЄmol-1
дђЗДгІH2SiF6(aq)+2Al(OH)3(s)=2AlF3(aq)+SiO2(s)+4H2O(l)ЕФІЄH=__kJЁЄmol-1ЁЃ
ЃЈ2ЃЉЗЯЫЎЕФЫсМюЖШМАЗЯЫЎжаЕФFe3+ЖдF-ХЈЖШЕФВтЖЈЖМЛсВњЩњвЛЖЈЕФгАЯьЁЃ
ЂйВтЖЈЪБЃЌЭЈГЃПижЦЗЯЫЎЕФpHдк5ЁЋ6жЎМфЁЃpHЙ§аЁЫљВтF-ХЈЖШЦЋЕЭЃЌЦфдвђЪЧ__ЁЃ
ЂкFe3+гыФћУЪЫсИљ(C6F5O73-)ЁЂF-ЗДгІПЩБэЪОЮЊFe3++nC6H5O73-![]() Fe(C6H5O7)n(3n-3)-ЁЂFe3++nF-
Fe(C6H5O7)n(3n-3)-ЁЂFe3++nF-![]() FeFn(3-n)ЁЃЯђКЌгаFe3+ЕФКЌЗњЗЯЫЎжаМгШыФћУЪЫсФЦ(C6H5O7Na3)ПЩЯћГ§Fe3+ЖдF-ВтЖЈЕФИЩШХЃЌЦфдвђЪЧ__ЁЃ
FeFn(3-n)ЁЃЯђКЌгаFe3+ЕФКЌЗњЗЯЫЎжаМгШыФћУЪЫсФЦ(C6H5O7Na3)ПЩЯћГ§Fe3+ЖдF-ВтЖЈЕФИЩШХЃЌЦфдвђЪЧ__ЁЃ
ЃЈ3ЃЉРћгУОлБНАЗПЩЮќИНШЅГ§ЫЎжаF-ЁЃгУЖшадЕчМЋЕчНтБНАЗ(![]() )КЭбЮЫсЕФЛьКЯвКПЩдкбєМЋЛёЕУОлБНАЗБЁФЄЃЌБфЛЏЙ§ГЬШчЭМЃК
)КЭбЮЫсЕФЛьКЯвКПЩдкбєМЋЛёЕУОлБНАЗБЁФЄЃЌБфЛЏЙ§ГЬШчЭМЃК
![]()
аДГібєМЋЩњГЩЖўОлЬхЕФЕчМЋЗДгІЗНГЬЪНЃК___ЁЃ
ЃЈ4ЃЉРћгУMgCO3ЁЂCa(OH)2КЭCaCO3ЕШПЩГСЕэШЅГ§ЗЯЫЎжаF-ЁЃ
ЂйвдMgCl2ШмвКЁЂФђЫи[CO(NH2)2]ЮЊдСЯПЩжЦЕУMgCO3ЃЌаДГіИУЗДгІЕФЛЏбЇЗНГЬЪНЃК__ЁЃ
ЂкШЁШ§ЗнЯрЭЌЕФКЌF-ЕФЫсадЗЯЫЎЃЌЗжБ№МгШызуСПЕФMgCO3ЁЂCa(OH)2КЭCaCO3ЁЃЯрЭЌЪБМфКѓШмвКЕФpHМАF-ВаСєСПШчЭМ1ЫљЪОЁЃЪЕМЪЗЯЫЎДІРэЙ§ГЬжаГЃбЁгУMgCO3ЕФРэгЩЪЧЃК__ЁЃ
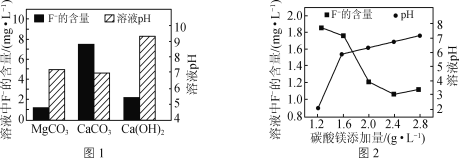
ЂлИФБфЬМЫсУОЬэМгСПЃЌДІРэКѓЗЯЫЎжаF-КЌСПМАШмвКpHЕФБфЛЏШчЭМ2ЫљЪОЁЃЬэМгСПГЌЙ§2.4gЁЄL-1КѓЃЌF-КЌСПТдгаЩ§ИпЕФдвђЪЧ___ЁЃ{Ksp(MgF2)=7.4ЁС10-11ЃЌKsp[Mg(OH)2]=5.6ЁС10-12}
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГаЉФбШмадЧІбЮПЩгУзїЭПСЯЃЌШчЧийИВЪЛцжаЪЙгУЕФЧІАз(PbCO3)КЭЛЦН№гъжаЛЦЩЋЕФPbI2ЁЃЪвЮТЯТЃЌPbCO3 КЭ PbI2 дкВЛЭЌЕФШмвКжаЗжБ№ДяЕНШмНтЦНКтЪБ-lgc(Pb2+)гы-lgc(CO32-)Лђ-lgc(I-)ЕФЙиЯЕШчЭМЫљЪОЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧ
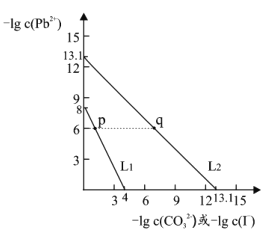
A.Ksp(PbCO3)ЕФЪ§СПМЖЮЊ 10-14
B.ЯрЭЌЬѕМўЯТЃЌЫЎЕФЕчРыГЬЖШ p ЕуДѓгк q Еу
C.L1 ЖдгІЕФЪЧ-lgc(Pb2+)гы-lgc(I-)ЕФЙиЯЕБфЛЏ
D.p ЕуШмвКжаМгШы Na2CO3 ХЈШмвКЃЌПЩЕУАзЩЋГСЕэ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЭЈЙ§ВтЖЈЗДгІЙ§ГЬжаЫљЗХГіЕФШШСППЩМЦЫужаКЭШШЁЃ50mL 0.50mol/LбЮЫсгы50mL 0.55mol/LNaOHШмвКдкЭМЪОЕФзАжУжаНјаажаКЭЗДгІЃЎЛиД№ЯТСаЮЪЬтЃК
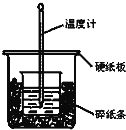
ЃЈ1ЃЉДгЪЕбщзАжУЩЯПДЃЌЭМжаЩаШБЩйЕФвЛжжВЃСЇвЧЦїЪЧ___________ЃЎ
ЃЈ2ЃЉДѓЩеБЩЯШчЙћВЛИЧгВжНАхЃЌЧѓЕУЕФжаКЭШШЪ§жЕ__________ЃЈЬюЁАЦЋДѓЁБЃЌЁАЦЋаЁЁБЛђЁАЮогАЯьЁБЃЉЃЎ
ЃЈ3ЃЉЪЕбщжаИФгУ60mL 0.50mol/LбЮЫсИњ50mL 0.55mol/LNaOHШмвКНјааЗДгІЃЌгыЩЯЪіЪЕбщЯрБШЃЌЫљЧѓжаКЭШШ________ЃЈЬюЁАЯрЕШЁБЁАВЛЯрЕШЁБЃЉЃЌМђЪіРэгЩЃК______________________ЃЎ
ЃЈ4ЃЉШєСНШмвКЕФУмЖШЖМЪЧ1g/mLЃЌжаКЭКѓЫљЕУШмвКЕФБШШШШнc=4.18J/ЃЈgЁЄЁцЃЉЃЌШ§ДЮЦНааВйзїВтЕУжежЙЮТЖШгыЦ№ЪМЮТЖШВюЃЈt2Љt1ЃЉЗжБ№ЮЊЃКЂй3.2Ёц Ђк2.2Ёц Ђл3.0ЁцЃЌаДГіБэЪОбЮЫсгыNaOHШмвКЗДгІЕФжаКЭШШЕФШШЛЏбЇЗНГЬЪН________________________ЃЎЃЈаЁЪ§ЕуКѓБЃСєвЛЮЛаЁЪ§ЃЉ
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com