
 .
. .
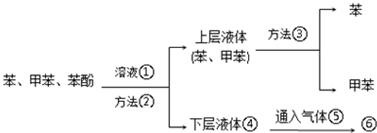
. 分析 混合物加入溶液①,经过方法②得到互不相溶的溶液,应为分液操作,甲苯、苯和氢氧化钠不反应,苯酚具有酸性能和氢氧化钠反应生成可溶性的苯酚钠,转移到下层溶液中,故溶液①为NaOH溶液,方法③为分离互溶的液体,应是分馏操作,苯酚的酸性比碳酸还弱,苯酚钠能和二氧化碳、水反应生成苯酚,故气体⑤为二氧化碳.
解答 解:混合物加入溶液①,经过方法②得到互不相溶的溶液,应为分液操作,甲苯、苯和氢氧化钠不反应,苯酚具有酸性能和氢氧化钠反应生成可溶性的苯酚钠,转移到下层溶液中,故溶液①为NaOH溶液,方法③为分离互溶的液体,应是分馏操作,苯酚的酸性比碳酸还弱,苯酚钠能和二氧化碳、水反应生成苯酚,故气体⑤为二氧化碳.
(1)方法②是将互不相溶的液体分离,采用分液的方法,方法③是将互溶的液体分离,采用分馏的方法分离,故答案为:分液;分馏;
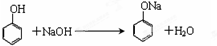
(2)苯酚能和氢氧化钠反应生成苯酚钠和水,反应方程式为 ,故答案为:
,故答案为: ;
;
(3)苯酚钠能和二氧化碳、水反应生成苯酚和碳酸氢钠,反应方程式为 ,故答案为:
,故答案为: .
.
点评 本题考查物质的分离提纯、苯酚的性质等,难度不大,注意苯酚钠和二氧化碳、水反应生成碳酸氢钠和苯酚,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | CsOH是一种既可与强酸又可与强碱反应的两性氢氧化物 | |
| B. | Cs在空气中燃烧可生成Cs2O和Cs2O2 | |
| C. | Cs与水反应,能发生爆炸,并放出H2 | |
| D. | CsOH很稳定,加热不易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸碱中和滴定时,用待测液润洗锥形瓶 | |
| B. | 酸碱中和滴定时,用冲洗干净的滴定管盛装标准溶液 | |
| C. | 滴定终点读数时,俯视滴定管的刻度,其他操作正确 | |
| D. | 酸式滴定管尖嘴部分开始实验时有气泡,滴定后无气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | υ正=υ逆≠0时的状态 | B. | NO2全部转变成N2O4的状态 | ||
| C. | c(NO2)=c(N2O4)的状态 | D. | 体系的颜色发生变化的状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Al>Mg>Na>H | B. | 热稳定性:NH3>PH3>H2S>HCl | ||
| C. | 元素非金属性:F>O>N>C | D. | 酸性:HClO4>H2SiO3>H3PO4>H2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01 mol•L-1 | B. | 0.017 mol•L-1 | C. | 0.05 mol•L-1 | D. | 0.50 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com