
【题目】常温下,向20mL0.1mol/LHA溶液中滴加0.1mol/L的氨水,溶液的pH随氨水的体积关系如图所示。下列说法不正确的是
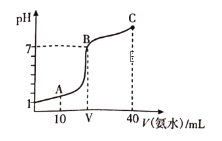
A. HA的电离方程式为HA=H++A-
B. B点时加入HA和氨水恰好完全反应
C. A点所示溶液中:c(A-)=2c(NH4+)+2c(NH3·H2O)
D. C点所示溶液中:c(NH4+)>c(A-)>c(NH3·H2O)
【答案】B
【解析】
根据图象可知,0.1mol/L的HA的pH=1,则c(H+)=0.1mol/L,与HA的浓度相等,HA为强酸。
A. 据分析可知HA为一元强酸,则其电离方程式为HA=H++A-,故A正确;
B. 加入HA和氨水恰好完全反应时,生成NH4A,为强酸弱碱盐,溶液显酸性,B点时溶液呈中性,故B错误;
C. A点时溶液为HA、NH4A,且物质的量相等,根据物料守恒,溶液中:c(A-)=2c(NH4+)+2c(NH3·H2O),故C正确;
D. C点时溶液为NH3·H2O、NH4A,且物质的量相等,溶液呈碱性,氨水的电离程度大于铵根离子的水解程度,则溶液中:c(NH4+)>c(A-)>c(NH3·H2O),故D正确;
答案为B。


科目:高中化学 来源: 题型:
【题目】如图所示,把盛有几小块镁片的试管放入盛有25℃的饱和石灰水的烧杯中,再用滴管向试管中滴入2 mL的稀盐酸。下列对烧杯中的实验现象的描述及原因说明正确的是( )
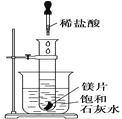
A. 烧杯中出现白色浑浊,原因是试管中的反应放出热量使烧杯中饱和石灰水温度升高,溶质析出
B. 烧杯中出现白色浑浊,原因是试管中的反应吸收热量使烧杯中饱和石灰水温度降低,溶质析出
C. 烧杯中没有任何现象,原因是试管中的反应对烧杯中饱和石灰水不会产生任何影响
D. 烧杯中没有任何现象,原因是试管中的反应既不放出热量,也不吸收热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子方程式BaCO3 + 2H+ = CO2↑ + H2O + Ba2+ 中的H+不能代表的物质是( )
①HCl;②H2SO4;③HNO3;④NaHSO4;⑤CH3COOH
A.①③B.①④⑤C.②④⑤D.⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题
(1)镁燃烧不能用CO2灭火,用化学方程式表示其理由________________________________。
(2)铝制品不能盛放碱性食品原因用离子方程式表示________________________________。
(3)不能用带磨口玻璃塞的试剂瓶盛装碱液的原因用离子方程式表________________________________。
(4)有一种石棉矿叫做青石棉,其化学式为Na2Fe5Si8H2O24,写成氧化物形式的化学式为____________。
(5)已知CuCL是白色难溶的物质,写出CuCL2溶液与SO2反应的离子方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼(B)及其化合物在化学工业中有诸多用途,请回答下列问题:
(1)硼氢化钠(NaBH4)是硼的重要化合物。
①NaBH4中B的化合价为_______________。
②工业上可利用硼酸甲酯[B(OCH3)3]与氢化钠(NaH)反应制备NaBH4反应的另种产物为甲醇钠(CH3ONa),该反应的化学方程式为______________________。
③NaBH4与水反应生成NaBO2和H2,该反应生成的氧化产物与还原产物的物质的量之比为____________________。
(2)工业上以铁硼矿(主要成分为Mg2B2O5H2O,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备单质B的工艺流程如图所示:
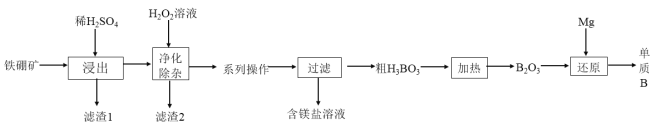
已知:相关金属离子生成氢氧化物沉淀的pH见表中数据:
金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ |
开始沉淀的pH | 2.7 | 3.7 | 5.8 | 9.6 |
完全沉淀的pH | 3.7 | 4.7 | 8.8 | 11 |
请回答下列问题:
①“浸出”时.将铁硼矿石粉碎的目的为___________________________。写出Mg2B2O5H2O与硫酸反应的化学方程式:____________________。
②滤渣1的主要成分为_____________________________。
③“净化除杂”时需先加H2O2溶液,其目的为_______________,然后再调节溶液的pH≈5,其目的是___________________________________。
④制得的粗硼在一定条件下能生成BI3 , BI3加热分解可以得到纯净的单质硼。现将0.025 g粗硼制成的BI3完全分解,生成的I2用0.30 molL-1 Na2S2O3溶液滴定(I2 +2S2O32-=2I-+ S4O6 2-)至终点,消耗 18.00 mLNa2S2O3溶液:盛装Na2S2O3溶液应用_____________填“酸式”或“碱式”)滴定管,该粗硼样品的纯度为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是( )
A. 将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水
B. 将pH=11的氨水稀释1000倍,测得pH>8,说明NH3·H2O为弱碱
C. 加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3受热不稳定
D. 将红热的Pt丝伸入右图所示的锥形瓶中,瓶口出现少量红棕色气体,说明氨气的氧化产物为NO2
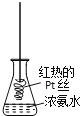
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是( )
A. 常温常压下,2.24 L H2O中含有极性共价键的数目为0.2NA
B. 0.1 mol·L-1NH4Cl溶液中含有NH![]() 的数目小于0.1NA
的数目小于0.1NA
C. 100 mL 12 mol·L-1的浓HNO3与过量Cu反应转移电子的数目为0.6NA
D. 标准状况下,11.2 L由CH4和C2H4组成的混合气体中含有氢原子的数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的短周期主族元素,它们形成的某种化合物阴离子结构如图。其中X、Z为同主族元素,Y最外层电子数是内层的3倍,W最外层电子数为核外电子总数的![]() ,下列说法正确的是()
,下列说法正确的是()

A.简单氢化物稳定性:W>Y
B.ZX与X2Y反应,ZX做还原剂,1molZX转移电子数为2NA
C.X2WY2–具有还原性
D.X、Z分别与Y形成的二元化合物中含有的化学键类型完全不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com