
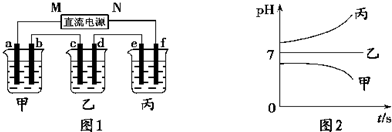
A、B、C三种强电解质,它们在水中电离出的离子为Na+、Ag+、NO3-、SO42-、Cl-,在如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙烧杯中c电极质量增加了10.8克。常温下各烧杯中溶液的pH与电解时间t的关系如图所示。据此回答下列问题:
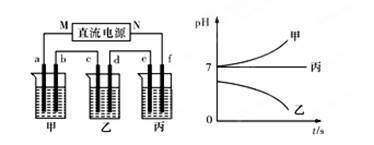
(1)M为电源的 极(填写“正”或“负”),甲、乙两个烧杯中的电解质分别为 、 (填写化学式)。
(2)计算电极f上生成的气体在标准状况下体积为 L。
(3)写出乙烧杯中的电解反应方程式: 。
(4)若电解后甲溶液的体积为10L,则该溶液的pH为 。
(1)负 NaCl AgNO3 (2)0.56L (3)4AgNO3+2H2O 4Ag+4HNO3+O2↑ (4)12
4Ag+4HNO3+O2↑ (4)12
【解析】
试题分析:(1)经过一段时间后,测得乙烧杯中c电极质量增加了10.8克,这说明c电极是阴极,则M是负极,N是正极,f是阳极,e是阴极,d是阴极,b是阴极,a是阴极。乙中电解后pH降低,说明酸性增强,因此电解液应该是硝酸银溶液。甲中pH升高,说明碱性增强,因此电解液应该是氯化钠。丙中pH不变,则相当于是电解水,因此电解液是硫酸钠或硝酸钠。
(2)c电极析出的单质银,物质的量=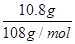 =0.1mol,转移电子的物质的量是0.1mol。f电极是阳极,溶液中的OH-放电,4OH--4e-=2H2O+O2↑。则根据电子转移守恒可知,生成氧气的物质的量是
=0.1mol,转移电子的物质的量是0.1mol。f电极是阳极,溶液中的OH-放电,4OH--4e-=2H2O+O2↑。则根据电子转移守恒可知,生成氧气的物质的量是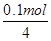 =0.025mol,标准状况下的体积=0.025mol×22.4L/mol=0.56L。
=0.025mol,标准状况下的体积=0.025mol×22.4L/mol=0.56L。
(3)乙中电解质是硝酸银溶液,则电解反应方程式为4AgNO3+2H2O 4Ag+4HNO3+O2↑。
4Ag+4HNO3+O2↑。
(4)甲中电解质是氯化钠,电解的方程式为2NaCl+2H2O 2NaOH+H2↑+Cl2↑,根据电子守恒可知,反应中生成氢氧化钠的物质的量是0.1mol,其浓度是
2NaOH+H2↑+Cl2↑,根据电子守恒可知,反应中生成氢氧化钠的物质的量是0.1mol,其浓度是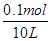 =0.01mol/L,则pH=12。
=0.01mol/L,则pH=12。
考点:考查电解原理的有关判断与应用


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42-、OH- |

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Na+、K+、Cu2+ | ||
| 阴离子 | SO
|

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42-、OH- |

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C三种强电解质,它们在水中电离出的离子如表所示:
 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com