
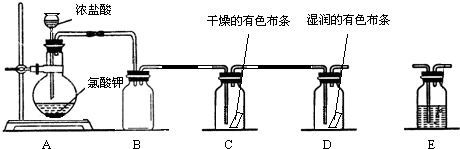
分析 (1)装置中反应试剂是浓盐酸易挥发,需要用分液漏斗加入;
(2)氯酸钾和浓盐酸反应生成氯气,氯化钾和水;
(3)制备出的氯气含有挥发出的氯化氢,通过饱和食盐水可以除去,减小氯气的溶解性;探究使有色布条褪色的是氯气还是氯气与水反应的生成物,需要在整套装置中添加装置E,其中加入浓硫酸,应在C装置前干燥氯气;
(4)铁在氯气中燃烧发出棕黄色烟氯化铁;
(5)氯气有毒排放到空气中污染环境,需要尾气吸收装置.
解答 解:(1)装置中反应试剂是浓盐酸易挥发,需要用分液漏斗加入,改长颈漏斗为分液漏斗,故答案为:改长颈漏斗为分液漏斗;
(2)氯酸钾和浓盐酸反应生成氯气,氯化钾和水,反应的化学方程式为:KClO3+6HCl=KCl+3Cl2↑+3H2O,故答案为:KClO3+6HCl=KCl+3Cl2↑+3H2O;
(3)制备出的氯气含有挥发出的氯化氢,通过饱和食盐水可以除去,减小氯气的溶解性;探究使有色布条褪色的是氯气还是氯气与水反应的生成物,需要在整套装置中添加装置E,其中加入浓硫酸,应在C装置前干燥氯气,选择装置B、C之间;
故答案为:饱和食盐水;b;
(4)铁在氯气中燃烧,集气瓶内和瓶口出现棕黄色烟氯化铁;故答案为:集气瓶内和瓶口出现棕黄色烟;
(5)氯气有毒排放到空气中污染环境,需要尾气吸收装置,在装置D后增加一个盛装浓碱液的装置,使碱液吸收逸出的氯气尾气,
故答案为:在装置D后增加一个盛装浓碱液的装置,使碱液吸收逸出的氯气尾气.
点评 本题考查了氯气制备方法和过程分析,氯气性质的理解应用,注意反应现象的掌握和离子检验方法的判断,掌握物质性质是和离子检验是解题关键,题目难度中等.


 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4 L氢气含有的氢分子数为NA | |
| B. | 常温常压下,18 g水含有的原子数为3NA | |
| C. | 23g Na在氧气中完全燃烧转移的电子数为 2NA | |
| D. | 0.3 mol/LNa2SO4溶液中含有Na+的数目为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Cl2作为氧化剂得到的电子数为NA | |
| B. | 在25℃,101kPa时,22.4L氢气中含有2NA个氢原子 | |
| C. | 14g氮气中含有7NA个电子 | |
| D. | NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:LiOH>NaOH>KOH | |
| B. | 熔点:I2>Br2>Cl2 | |
| C. | 热稳定性:HF>HCl>HBr | |
| D. | 若X2-的核外电子数目为18,则元素X在第三周期ⅥA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
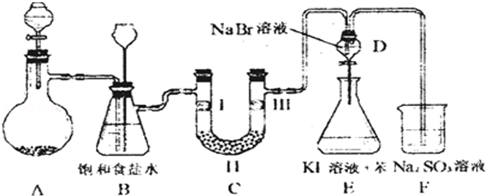
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
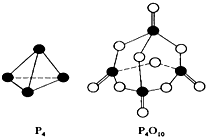 白磷在氧气中燃烧的反应为:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ•mol-1、P-O b kJ•mol-1、P=O c kJ•mol-1、O=O d kJ•mol-1.根据图示的分子结构和有关数据下列推断正确的是( )
白磷在氧气中燃烧的反应为:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ•mol-1、P-O b kJ•mol-1、P=O c kJ•mol-1、O=O d kJ•mol-1.根据图示的分子结构和有关数据下列推断正确的是( )| A. | 6a+5d<4c+10b | B. | △H=(4c+12b-6a-5d) kJ•mol-1 | ||
| C. | 6a+5d>4c+12b | D. | △H=(6a+5d-4c-12b) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2 L氧气中所含有的原子数为NA | |
| B. | 标准状况下,22.4LCCl4所含分子数为NA | |
| C. | 7.8g的Na2O2中含有的阴离子的数目为0.2NA | |
| D. | 27g Al分别与足量的稀硫酸及氢氧化钠溶液反应失去的电子数都是3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com