
 金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度.它无电时也无需充电,只需更换其中的某些材料即可,其工作原理如图,下列说法正确的是( )
金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度.它无电时也无需充电,只需更换其中的某些材料即可,其工作原理如图,下列说法正确的是( )| A. | 有机电解液可以是乙醇等无水有机物 | |
| B. | 放电时,电池反应为:4Li+O2=2Li2O | |
| C. | 电池正极反应式是O2+4e-=2O2- | |
| D. | 在更换锂电极的同时,要更换水性电解液 |
分析 在锂燃料电池中,锂易失电子而作负极,电极反应式为Li-e-=Li+,以空气中的氧气作为正极反应物,水性电解液,氧气得电子生成氢氧根离子,电极反应式为2H2O+O2+4e-=4OH-,据此分析解答.
解答 解:A.电解液不能是乙醇,因为乙醇与金属锂要发生置换反应,故A错误;
B.负极反应为4Li-4e-=4Li+,正极反应为O2+2H2O+4e-=4OH-,总反应为4Li+O2+2H2O=4LiOH,故B错误;
C.正极上是氧气得电子生成氢氧根离子,则正极反应为O2+2H2O+4e-=4OH-,故C错误;
D.负极材料Li不断损耗,需要补充,水性电解液中氢氧化锂达到饱和,也需要更换,故D正确;
故选D.
点评 本题考查新型燃料电池的工作原理,为高频考点,明确燃料电池正负极反应是解题关键,侧重于考查学生的分析能力,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:计算题
 在1L密闭容器中进行反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)的变化如图所示.
在1L密闭容器中进行反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,它可以发生反应的类型有( )
,它可以发生反应的类型有( )| A. | ①②③④ | B. | ①②⑤⑥ | C. | ①②④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
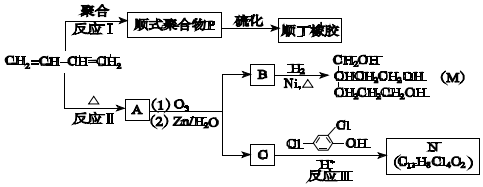
 +
+ $\stackrel{△}{→}$
$\stackrel{△}{→}$
 ;
;


 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当2a=b时,溶液中生成的沉淀质量最大 | |
| B. | 当a=2b时,发生的离子反应为2NH4++SO42-+Ba2++2OH-═BaSO4↓+2NH3•H2O | |
| C. | 当2b≤3a时,发生的离子反应为3SO42-+2Al3++3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ | |
| D. | 当2a<b≤2.5a时,溶液中的n(AlO2-)为0.02(b-2a) mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物共有5种 | |
| B. | 菲的结构简式如图 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 | |
| C. | 与 互为同分异构体的芳香族化合物有6种 互为同分异构体的芳香族化合物有6种 | |
| D. | 某饱和链烃,分子中含有5个碳原子的,其一氯取代物共有8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,求出的中和热数值和原来相同 | |
| B. | 用50 mL 0.50 mol/L盐酸和50 mL 0.55 mol/L NaOH进行实验比用 50 mL 0.50 mol/L盐酸和50 mL 0.50 mol/L NaOH测得的数值准确 | |
| C. | 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌 | |
| D. | 装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com