

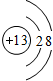 ,MgO的电子式
,MgO的电子式 .
.分析 已知某抗酸药X的组成可表示为aMgCO3•bMg(OH)2•cAl(OH)3•dH2O,加热灼烧得到氧化镁、氧化铝、二氧化碳和水,加入氢氧化钠溶液氧化铝溶解生成四羟基合铝酸钠,
(1)铝是13号元素,最外层有3个电子,Al3是将原子的外层电子失去,次外层做最外层;MgO是离子化合物,由Mg2+离子和O2-离子构成;
(2)加入NaOH溶液发生的反应是aMgCO3•bMg(OH)2•cAl(OH)3•dH2O分解产物中的氧化铝和氢氧化钠溶液反应生成四羟基合铝酸钠;
(3)①检查装置气密性,可以依据装置内加入水后压强的变化和液面变化分析;
②混合药品的正确操作是将稀硫酸转移到抗酸药X中,硫酸为液体倾斜后进入药品一端充分发生反应;
③量气管和水准管液面相同,温度降低到室温,读取读数需要视线和液面凹液面最低处相平;
(4)取6.02gX和过量稀硫酸反应生成气体为二氧化碳,收集到二氧化碳气体0.24L,已知20℃,1个大气压下,气体摩尔体积为24.0L•mol-1,二氧化碳物质的量=$\frac{0.24L}{24L/mol}$=0.01mol,则MgCO3物质的量为0.01mol,固体6.02g灼烧质量减小为二氧化碳和水蒸气,3.42g加入氢氧化钠溶液溶解后固体质量为2.4g为氧化镁的质量,物质的量n(MgO)=$\frac{2.4g}{40g/mol}$=0.06mol,元素守恒可知Mg(OH)2物质的量n(Mg(OH)2)=0.06mol-0.01mol=0.05mol,减少的固体质量为氧化铝的质量,物质的量n(Al2O3)=$\frac{3.42g-2.4g}{102g/mol}$=0.01mol,则结晶水合物中结晶水物质的量n(H2O),依据元素守恒计算得到.
解答 解:(1)铝是13号元素,最外层有3个电子,Al3+是将原子的外层电子失去,次外层做最外层,离子结构示意图为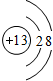 ,MgO是离子化合物,由Mg2+离子和O2-离子构成,MgO的电子式为
,MgO是离子化合物,由Mg2+离子和O2-离子构成,MgO的电子式为 ,
,
故答案为: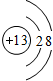 ;
; ;
;
(2)加入NaOH溶液发生的反应是aMgCO3•bMg(OH)2•cAl(OH)3•dH2O分解产物中的氧化铝和氢氧化钠溶液反应生成四羟基合铝酸钠,反应的离子方程式为:Al2O3+2OH-+3H2O=2[Al(OH)4]-,
故答案为:Al2O3+2OH-+3H2O=2[Al(OH)4]-;
(3)①检查该装置气密性的方法是:向水准管加入一定量的水,水准管与量气管液面形成高度差,在一段时间内不变,
故答案为:向水准管加入一定量的水,水准管与量气管液面形成高度差,在一段时间内不变;
②混合药品的正确操作是将稀硫酸转移到抗酸药X中,硫酸为液体倾斜后进入药品一端充分发生反应,原因是确保抗酸药X完全反应,
故答案为:确保抗酸药X完全反应;
③反应完毕,收集到气体0.24L.读取气体体积时,除视线要与刻度线相平外,还应注意冷却至室温(或20℃),水准管与量气管的液面相平,减少测定气体体积误差,
故答案为:冷却至室温(或20℃),水准管与量气管的液面相平;
(4)取6.02gX和过量稀硫酸反应生成气体为二氧化碳,收集到二氧化碳气体0.24L,已知20℃,1个大气压下,气体摩尔体积为24.0L•mol-1,二氧化碳物质的量=$\frac{0.24L}{24L/mol}$=0.01mol,则MgCO3物质的量为0.01mol,固体6.02g灼烧质量减小为二氧化碳和水蒸气,3.42g加入氢氧化钠溶液溶解后固体质量为2.4g为氧化镁的质量,物质的量n(MgO)=$\frac{2.4g}{40g/mol}$=0.06mol,元素守恒可知Mg(OH)2物质的量n(Mg(OH)2)=0.06mol-0.01mol=0.05mol,减少的固体质量为氧化铝的质量,物质的量n(Al2O3)=$\frac{3.42g-2.4g}{102g/mol}$=0.01mol,
则结晶水合物中n(H2O)=$\frac{6.02g-0.01mol×84g/mol-0.05mol×58g/mol-0.02mol×78g/mol}{18g/mol}$=0.04mol,
aMgCO3•bMg(OH)2•cAl(OH)3•dH2O中,a:b:c:d=0.01mol:0.05mol:0.02mol:0.04mol=1:5:2:4,
化学式为:MgCO3•5Mg(OH)2•2Al(OH)3•4H2O,
故答案为:MgCO3•5Mg(OH)2•2Al(OH)3•4H2O.
点评 本题考查了微粒表示方法、检验物质分解生成产物的实验过程和定量计算、气体测量方法和注意问题,掌握基础是解题关键,题目难度中等.


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:选择题
| A. | c(O2)=0.2 mol/L | B. | c(SO2)=0.25 mol/L | ||
| C. | c(SO2)+c(SO3)=0.3 mol/L | D. | c(SO2)=c(SO3)=0.15 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用大阳能制氢时,若光解0.02molH2O可生成H2的质量为0.02g | |
| B. | 用生氢剂CaH2与水反应制氢时,生成1mol H2时转移电子致目为2NA | |
| C. | 常温常压下,4.0g氢氧化钠溶于1L水所得溶液c(NaOH)=0.10mol/L | |
| D. | 标准状况下,22.4LCH3Cl中含有的共用电子对数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和②产物的阴阳离子个数比不相等 | |
| B. | ①和②生成等物质的量的产物,转移电子数不同 | |
| C. | 25℃、101kPa下Na2O(s)+O2(g)═2Na2O2(s)△H=-142kJ/mol | |
| D. | 25℃、101kPa下Na2O2(s)+2Na(g)═2Na2O(s)△H=-317kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ③④⑤⑥ | C. | ②③④⑤ | D. | ①②⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入KSCN溶液不一定变红色 | B. | 溶液中一定含Cu2+ | ||
| C. | 溶液中一定不含Fe3+ | D. | 剩余固体中一定是Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含1molFeCl3的饱和溶液滴入沸水中得到胶体数目为NA | |
| B. | 在标准状况下,22.4LCl2和HCl的混合气体中含有的分子总数为2×6.02×1023 | |
| C. | 常温常压下,7.8gNa2S固体和7.8gNa2O2固体中含有的阴离子数目均为0.1NA | |
| D. | 标准状况下,Na2O2与足量的CO2反应生成2.24LO2,转移电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 、
、 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com