
|
在由水电离出的c(OH-)=1×10-13 mol·L-1的溶液中,下列各组离子一定不能大量共存的是 | |
| [ ] | |
A. |
Na+、NH4+、NO3-、CO32- |
B. |
K+、I-、Mg2+、SO42- |
C. |
Na+、Ba2+、OH-、NO3- |
D. |
C1-、K+、NO3-、SO32- |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (K) |
7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
 ,下列说法正确的是
,下列说法正确的是 SO2Cl2(l)△H=-97.3kJ?mol-1
SO2Cl2(l)△H=-97.3kJ?mol-1查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (Ka) |
7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
| c(H+) |
| c(HF) |
| c(OH-) |
| c(H+) |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省吉安市高三上学期期末教学质量评价化学试卷(解析版) 题型:填空题
开发使用清洁能源,发展“低碳经济”正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)甲烷水蒸气转化法制H2的主要转化反应如下:
CH4(g) + H2O(g) CO(g) + 3H2(g)? △H=+206.2 kJ·mol-1
CO(g) + 3H2(g)? △H=+206.2 kJ·mol-1
CH4(g) + 2H2O(g) CO2(g) + 4H2(g)? △H=+165.0 kJ·mol-1
CO2(g) + 4H2(g)? △H=+165.0 kJ·mol-1
上述反应所得原料气中的CO能使合成氨的催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是??????? 。
(2)生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g)  CO(g) + 3H2(g)? ΔH>0
CO(g) + 3H2(g)? ΔH>0
①一定条件下CH4的平衡转化率与温度、压强的关系如图a。则A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为___________。(填“<”、“>”、“=” );

②100℃时,将1 mol CH4和2 mol H2O通入容积为1 L的定容密封容器中,发生反应,能说明该反应已经达到平衡状态的是__________
a.容器内气体密度恒定??
b.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
c.容器的压强恒定??????
d.3v正(CH4) = v逆(H2)
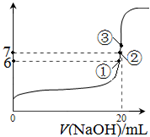
(3)25℃时,在20mL0.1mol/L氢氟酸中加入VmL0.1mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_____。

A.pH=3的HF溶液和pH=11的NaF溶液中, 由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(Na+)=0.1mol/L
(4)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H—O—F。HFO与水反应得到HF和化合物A,该反应的化学方程式为????????????????????? 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年北京市石景山区高三第一学期期末考试化学试卷(解析版) 题型:填空题
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
|
化学式 |
HF |
H2CO3 |
HClO |
|
电离平衡常数 (Ka) |
7.2×10-4 |
K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
(1)已知25℃时,①HF(aq)+OH—(aq)=F—(aq)+H2O(l) ΔH=-67.7kJ/mol,
②H+(aq)+OH—(aq)=H2O(l) ΔH=-57.3kJ/mol ,
氢氟酸的电离方程式及热效应可表示为________________________。
(2)将浓度为0.1 mol/LHF溶液加水稀释一倍(假设温度不变),下列各量增大的是____。
A.c(H+) B.c(H+)·c(OH—) C. D.
D.
(3)25℃时,在20mL0.1mol/L氢氟酸中加入VmL0.1mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_____。

A.pH=3的HF溶液和pH=11的NaF溶液中, 由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F—)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F—)=c(Na+)
D.③点时V=20mL,此时溶液中c(F—)< c(Na+)=0.1mol/L
(4)物质的量浓度均为0.1mol/L的下列四种溶液: ① Na2CO3溶液 ② NaHCO3溶液 ③ NaF溶液 ④NaClO溶液。依据数据判断pH由大到小的顺序是______________。
(5)Na2CO3溶液显碱性是因为CO32—水解的缘故,请设计简单的实验事实证明之
___________________________________________________________。
(6)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H—O—F。HFO与水反应得到HF和化合物A,每生成1molHF转移 mol电子。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年重庆市高三5月月考(理综)化学部分 题型:填空题
I.(1)CH3OH(1)、H2的燃烧热分别为:725.5 kJ/mol和285.8 kJ/mol,写出工业上以CO2、H2合成CH3OH(1)的热化学方程式: 。
(2)右图为光电解水的装置,写出光照时半导体电极表面发生的电极反应式________。目前应用最多的半导体材料是Si,甚至有人提出硅是“21世纪的能源”,硅可作为新能源的原因可能的是 (填字母)。
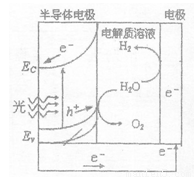
a.在自然界中存在大量的单质硅
b.硅可以通过化学方法“再生”
c.硅具有较强的亲氧性,燃烧放出的热量多
d.硅的化学性质不活泼,便于安全贮存、运输
II.将0.2mol/L HA溶液与O.lmol/L NaOH溶液等体积混合,测得混合溶液c(Na+)>c(A—),
用“>”、“<”或“=”填写下列空白:
(1)混合溶液中c(A—)____c(HA);c(HA)+c(A—)__0.lmol/L;
(2)混合溶液中,由水电离出来的c(OH—) 0.2mol/L HA溶液中由水电离出的c(H+)
(3)25℃时,如果取0.2mol/L HB溶液与0.lmol/L NaOH溶液等体积混合,测得混合溶液的pH <7,则HB的电离程度 NaB的水解程度。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com