
分析 (1)根据醋酸溶液中电荷守恒可知:c(H+)═c(OH-)+c(CH3COO-),进而计算c(CH3COO-);
醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离;
(2)盐酸、醋酸均为一元酸,足量的Zn与等体积酸反应时,酸的浓度越大,可以提供氢离子多,生成氢气体积越大;
开始的反应速率取决于开始时氢离子浓度的大小;
(3)溶液显中性,则c(H+)=c(OH-)=10-7mol/L,根据电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),可得c(Na+)=c(CH3COO-),溶液中还存在CH3COOH.
解答 解:(1)在 pH=5的稀醋酸溶液中,c(H+)=10-5mol/L,则c(OH-)=10-9mol/L,根据醋酸溶液中电荷守恒可知:c(H+)═c(OH-)+c(CH3COO-),可以看出,c(CH3COO-)=c(H+)-c(OH-)=(10-5-10-9)mol/L;
a.加入少量0.10mol•L-1的稀盐酸,溶液中氢离子浓度增大,抑制醋酸的电离,则醋酸的电离程度降低,故错误;
b.醋酸的电离是吸热反应,加热促进醋酸的电离,则醋酸的电离程度增大,故正确;
c.加水稀释至0.010mol•L-1,促进醋酸的电离,则醋酸的电离程度增大,故正确;
d.加入少量冰醋酸,醋酸的电离平衡向正反应方向移动,但醋酸的电离程度降低,故错误;
e.加入少量氯化钠固体,不影响平衡的移动,则不改变醋酸的电离,故错误;
f.加入少量0.10mol•L-1的NaOH溶液,氢氧根离子和氢离子反应生成水,氢离子浓度降低,促进醋酸的电离,则醋酸的电离程度增大,故正确;
故答案为:(10-5-10-9)mol/L;bcf;
(2)醋酸是弱酸,随着它和金属的反应,电离平衡不断地向右移动,会电离出更多的氢离子,所以醋酸产生的氢气体积较大,开始时,醋酸和盐酸的pH均等于3,即开始时氢离子的浓度相等,所以开始时的速率相等,故答案为:<;=;
(3)醋酸溶液是弱酸,pH为3的醋酸溶液中,醋酸的浓度大于10-3mol/L,pH=11的NaOH溶液浓度等于10-3mol/L,最后溶液恰好呈中性,说明碱多,所以Vb>Va,溶液恰好呈中性,氢离子和氢氧根的浓度一定相等,根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),所以c(Na+)=c(CH3COO-),
故答案为:Va<Vb; c(Na+)=c(CH3COO-)>c(H+)=c(OH).
点评 本题考查弱电解质的电离、离子浓度大小比较等知识,侧重于盐类水解和弱电解质电离的考查,题目难度中等,注意熟练掌握弱电解质的电离平衡及其影响因素,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
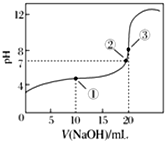 常温下,用0.100 0mol•L-1 NaOH溶液滴定20.00mL 0.100 0mol•L-1 CH3COOH溶液滴定曲线如图所示.下列说法正确的是( )
常温下,用0.100 0mol•L-1 NaOH溶液滴定20.00mL 0.100 0mol•L-1 CH3COOH溶液滴定曲线如图所示.下列说法正确的是( )| A. | 点①所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| B. | 点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| C. | 点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 甲基橙 | 甲基红 | 石蕊 | 酚酞 |
| 变色范围(pH) | 3.1-4.4 | 4.4-6.2 | 5.0-8.0 | 8.2-10.0 |
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 21.02 | 20.32 | 20.28 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
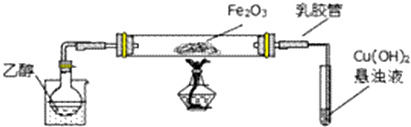
 某研究性学习小组为了证明在同温同压下,相同浓度相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图所示.该实验的主要操作步骤如下:
某研究性学习小组为了证明在同温同压下,相同浓度相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图所示.该实验的主要操作步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
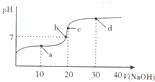 室温时,向20mL0.1mol•L-1的醋酸溶液中不断滴人0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )
室温时,向20mL0.1mol•L-1的醋酸溶液中不断滴人0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )| A. | a点时:c( CH3COOH)>c( Na+)>c( CH3COO-)>c( H+)>c( OH -) | |
| B. | b点时:c( Na+)=c( CH3COO-)>c(H+)=c( OH-) | |
| C. | c点时:c(H+)=c(CH3COOH)+c( OH-) | |
| D. | d点时:c(Na+)>c(CH3COO -)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
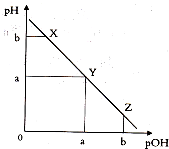 某温度下,向一定体积0.1mol.L一1氨水溶液中逐滴加入等浓度的盐酸,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如图所示.下列说法不正确是( )
某温度下,向一定体积0.1mol.L一1氨水溶液中逐滴加入等浓度的盐酸,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如图所示.下列说法不正确是( )| A. | 此温度下,水的离子积常数为1.0×l0-2a | |
| B. | X点和Z点所示溶液中H2O的电离程度相同 | |
| C. | X、Y、Z三点所示的溶液中:c(NH4+)+c(H+)═c(Cl-)+c(OH-) | |
| D. | Y点消耗盐酸的体积等于氨水的体积 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com