
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
分析 Ⅰ.(1)根据化合价代数和为零计算Co的化合价;
(2)酸浸时反应物有硫酸、过氧化氢以及LiCoO2,生成物有Li2SO4和CoSO4,Co元素化合价降低,则过氧化氢被氧化为氧气,同时生成水,由题中信息知LiCoO2具有强氧化性,加入盐酸有污染性气体氯气生成;
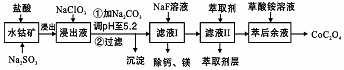
Ⅱ.含钴废料中加入盐酸,可得CoCl3、FeCl3、AlCl3、MnCl2、MgCl2、CaCl2,信息①中浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等,则加入的Na2SO3将Co3+、Fe3+还原为Co2+、Fe2+,工艺流程最终得到草酸钴,加入NaClO3将Fe2+氧化为Fe3+,加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2、MnCl2、MgCl2、CaCl2,用NaF溶液除去钙、镁,过滤后,向滤液中加入萃取剂,将锰离子萃取,萃取后的余液中主要含有CoCl2,进入草酸铵溶液得到草酸钴,据此解答.
解答 解:Ⅰ.(1)钴酸锂(LiCoO2)中Li为+1价,O为-2价,则钴元素的化合价为+3,
故答案为:+3;
(2)酸浸时反应物有硫酸、过氧化氢以及LiCoO2,生成物有Li2SO4和CoSO4,Co元素化合价降低,则过氧化氢被氧化为氧气,同时生成水,反应方程式为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2+4H2O,因为盐酸也具有强酸性和还原性,理论上可以代替H2SO4和H2O2,但上述反应可知LiCoO2具有强氧化性,加入盐酸有污染性气体氯气生成,
故答案为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2+4H2O;生成的氯气造成污染,且盐酸易挥发,浪费很大;
Ⅱ.(3)要使Fe2+沉淀的pH=9.6,Co2+沉淀的pH=9.2,如直接除掉Fe2+,溶液中的Co2+也沉淀下来,Fe3+沉淀的pH=3.7,所以加NaClO3将浸出液中Fe2+氧化为Fe3+,利于从混合液中除去,
故答案为:将Fe2+氧化为Fe3+,利于从混合液中除去;
(4)加Na2CO3调PH=5.2能使Fe3+、Al3+ 离子转化成氢氧化物沉淀,原因是:因Fe3+和Al3+(用M3+代替)在水溶液中存在平衡M3++H2O?M(OH)3+3H+,加入碳酸钠后CO32-与H+结合生成难电离的HCO3-,使水解平衡右移而产生沉淀,
故答案为:因Fe3+和Al3+(用M3+代替)在水溶液中存在平衡M3++H2O?M(OH)3+3H+,加入碳酸钠后CO32-与H+结合生成难电离的HCO3-,使水解平衡右移而产生沉淀;
(5)由工艺流程可知溶液中的锰离子还未除去,最终得到草酸钴,说明滤液中加入萃取剂的作用是除去锰离子;
故答案为:除去Mn2+;
(6)由溶度积可知,滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为CaF2、MgF2沉淀,根据溶度积可知c(Mg2+):c(Ca2+)=$\frac{{K}_{sp}(Mg{F}_{2})}{{K}_{sp}(Ca{F}_{2})}$=$\frac{7.35×1{0}^{-11}}{1.05×1{0}^{-10}}$=0.7,
故答案为:0.7.
点评 本题考查物质制备工艺流程,涉及对操作与原理的分析评价、物质的分离提纯、溶度积有关计算、盐类水解、氧化还原反应等知识点等,侧重考查学生分析能力、获取信息能力,是对学生综合能力的考查.


科目:高中化学 来源: 题型:选择题
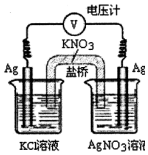 一定条件下,实验室利用如图所示装置,通过测电压求算Kkp(AgCl).工作一段时间后,两电极质量均增大.下列说法正确的是( )
一定条件下,实验室利用如图所示装置,通过测电压求算Kkp(AgCl).工作一段时间后,两电极质量均增大.下列说法正确的是( )| A. | 右池中的银电极作正极 | B. | 总反应为Ag++Cl-═AgCl | ||
| C. | 正极反应为Ag-e-═Ag+ | D. | 盐桥中的NO3-向右池方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 精铜板作阴极,纯铜片作阳极,CuSO4溶液作电解液 | |
| B. | 电解时,阴极发生氧化反应,则阴极发生的反应为:Cu2++2e-═Cu | |
| C. | 粗铜中所含Ni、Fe、Zn等金属杂质,电解后以单质形式沉积槽底,形成阳极泥 | |
| D. | 电解铜的纯度可达99.95%~99.98% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 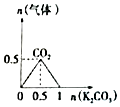 n (HCl)=1mol,K2CO3加入到HCl溶液中,在敝口容器中生成的气体 | |
| B. | 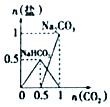 n(NaOH)=1mol,CO2通入到NaOH溶液中反应生成的盐 | |
| C. | 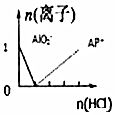 n(NaAlO2)=1mol,HCl加入到NaAlO2溶液中离子的存在情况 | |
| D. | 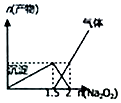 n(AlCl3)=1mol,Na2O2加入AlCl3溶液反应的产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
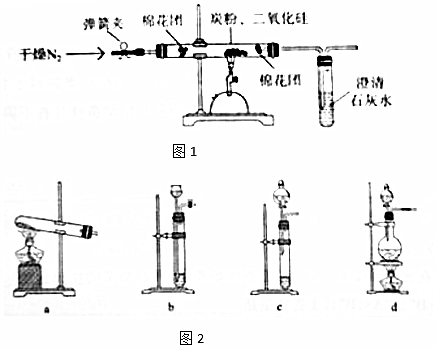
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
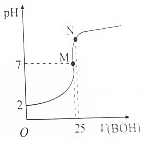 25℃时,向25mL 0.1000mol•L-1HA溶液滴加同浓度的BOH溶液,混合溶液pH随滴加BOH溶液的变化如下图所示.下列有关叙述错误的是( )
25℃时,向25mL 0.1000mol•L-1HA溶液滴加同浓度的BOH溶液,混合溶液pH随滴加BOH溶液的变化如下图所示.下列有关叙述错误的是( )| A. | BA溶液呈碱性 | |
| B. | 酸HA的电离常数约为0.0011 | |
| C. | M点时,c(B+)=c(A-)>c(H+)=c(OH-) | |
| D. | N点时加入10mL0.1000mol•L-1HA溶液,将促进A-的水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na的原子结构示意图: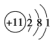 | |
| B. | 含有6个质子和7个中子的碳元素的核素符号:${\;}_{6}^{13}$C | |
| C. | 氮气的电子式::N:::N: | |
| D. | 用电子式表示氧化钠的形成过程: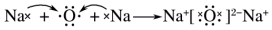 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com