
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)从氯化钾溶液中得到氯化钾固体,选择装置________(填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置________。
(2)从油水混合物中分离出植物油,选择装置________,该分离方法的名称为________。
(3)装置A中①的名称是________,进水的方向是从________口进水。装置B在分液时为使液体顺利滴下,除打开活塞外,还应进行的具体操作是______________________。
(4)海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验:
![]()
![]()
![]()
![]()
![]() ―→
―→![]()
粗盐中含Ca2+、Mg2+、Fe3+、SO![]() 等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:
等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:
①加入过量的Na2CO3溶液 ②加入过量的BaCl2溶液 ③加入过量的NaOH溶液 ④调节溶液的pH等于7 ⑤溶解 ⑥过滤 ⑦蒸发
正确的操作顺序是________(填选项字母)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦ c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
【答案】 D A B 分液 冷凝管 下 将分液漏斗上部的玻璃塞打开 ad
【解析】试题分析:A为蒸馏装置,B为萃取和分液装置,C为过滤装置,D为蒸发结晶装置。
(1)从氯化钾溶液中得到氯化钾固体应蒸发结晶,选择装置D;除去自来水中的Cl-等杂质应蒸馏,选择装置A。
(2)从油水混合物中分离出植物油,因为油和水不相溶,所以选择装置B,该分离方法的名称为分液。
(3)装置A中①的名称是冷凝管,进水的方向是从下口进水。装置B在分液时为使液体顺利滴下,除打开活塞外,还应进行的具体操作是将分液漏斗上部的玻璃塞打开。
(4)除去粗盐中含Ca2+、Mg2+、Fe3+、SO![]() 等杂质,方法是先溶解,然后依次加入沉淀剂把这些杂质离子沉淀,过滤,最后向滤液加盐酸除去过量的Na2CO3溶液和NaOH溶液。通常用Na2CO3溶液沉淀Ca2+,用NaOH溶液沉淀Mg2+和Fe3+,用BaCl2溶液沉淀SO
等杂质,方法是先溶解,然后依次加入沉淀剂把这些杂质离子沉淀,过滤,最后向滤液加盐酸除去过量的Na2CO3溶液和NaOH溶液。通常用Na2CO3溶液沉淀Ca2+,用NaOH溶液沉淀Mg2+和Fe3+,用BaCl2溶液沉淀SO![]() ,其关键是把Na2CO3溶液放在BaCl2溶液之后使用,这样可以除去过量的BaCl2,所以提纯的步骤正确的有ad。
,其关键是把Na2CO3溶液放在BaCl2溶液之后使用,这样可以除去过量的BaCl2,所以提纯的步骤正确的有ad。


科目:高中化学 来源: 题型:
【题目】将Na2O2投入FeCl3溶液中,对观察到的现象描述准确的是
A.生成白色沉淀 B.生成红褐色沉淀
C.有气泡产生 D.生成红褐色沉淀、有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A 元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2。
(1)六种元素中第一电离能最小的是 (填元素符号,下同),电负性最大的是 。
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂)。请写出黄血盐的化学式 ,1 mol AB-中含有π键的数目为 ,黄血盐晶体中各种微粒间的作用力不涉及 (填选项字母)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.分子间的作用力
(3)E2+的价层电子排布图为 ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③![]() 、④HCHO。其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质) 。
、④HCHO。其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质) 。
(4)金属C、F晶体的晶胞结构如图(请先判断对应的图),C、F两种晶体晶胞中金属原子的配位数之比为 。金属C的晶胞中,若设该晶胞的密度为a g/cm3,阿伏加德罗常数的值为NA,C原子的摩尔质量为M,则表示C原子半径的计算式为 cm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含有磷化氢。以下关于PH3的叙述正确的是 ( )
A. PH3分子中有未成键的孤对电子 B. PH3是非极性分子
C. 它的分子构型是平面三角形 D. 磷原子采用sp2杂化方式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子键、共价键、和分子间作用力是微粒之间的不同作用力。下列物质中只含有上述一种作用力的是
A. 冰 B. 碘单质 C. 氢氧化钠 D. 氯化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[选修3:物质结构与性质](20分)
Ⅰ(6分)下列叙述正确的有
A.某元素原子核外电子总数是最外层电子数的5倍,则其最高正价为+7
B.钠元素的第一、第二电离能分别小于镁元素的第一、第二电离能
C.高氯酸的酸性与氧化性均大于次氯酸的酸性和氧化性
D.邻羟基苯甲醛的熔点低于对羟基苯甲醛的熔点
Ⅱ(14分)ⅣA族元素及其化合物在材料等方面有重要用途。回答下列问题:
(1)碳的一种单质的结构如图(a)所示。该单质的晶体类型为___________,原子间存在的共价键类型有________,碳原子的杂化轨道类型为__________________。
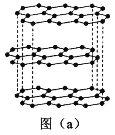


(2)SiCl4分子的中心原子的价层电子对数为__________,分子的立体构型为________,属于________分子(填“极性”或“非极性”)。
(3)四卤化硅SiX4的沸点和二卤化铅PbX2的熔点如图(b)所示。
①SiX4的沸点依F、Cl、Br、I次序升高的原因是_________________。
②结合SiX4的沸点和PbX2的熔点的变化规律,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性_______、共价性_________。(填“增强”“不变”或“减弱”)
(4)碳的另一种单质C60可以与钾形成低温超导化合物,晶体结构如图(c)所示。K位于立方体的棱上和立方体的内部,此化合物的化学式为_______________;其晶胞参数为1.4 nm,晶体密度为_______g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示各装置和实验室制取氧气的原理,回答下列问题:

(1)仪器A、B的名称分别为_____、_________。
(2)用mgMnO2和n g KC1O3组成的固体混合物加热制取氧气时,可选用的实验装置是_____(填装罝序号)。
(3)将MnO2和KC1O3的混合物充分加热至不再产生氧气时,若要将其中的催化剂MnO2回收再利用,应进行的实验操作是将固体冷却、加水溶解、______、洗涤、干燥;洗涤MnO2固体的操作方法为_______________________。证明MnO2固体已洗涤干净的操作方法为____________________。
(4)将(2)中的固体混合物加热一段时间,冷却后称得剩余固体质量为p g,则当(m+n-p):n=___时,表明KC1O3已完全分解。
(5)用双氧水和MnO2制取氧气时,不能选用装置c,其原因是________________。
(6)用装置d制取氨气时,所需的化学药品是 ________________,氨气的电子式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香酸类物质F常用做香精的调香剂。F的—种合成路线如下:
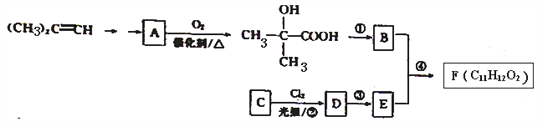
己知:A能发生银镜反应。回答下列问题:
(1)(CH3)2=CH2的化学名称为_________________,上述反应①、②、③、④中属于取代反应的有_______________。
(2)C的结构简式为_________,D中通过反应②引人的官能团名称为____________。
(3)①的反应条件是__________________。
(4)④的化学方程式为________________。
(5)B的同分异构体中,既能发生银镜反应又能发生水解反应的共有____种(不体异构),其中核磁共振氢谱显示为三组峰,且峰面积比为1:1:4的是________(填结构简式)。
(6)写出用(CH3)2C=CH2为原料(无机试剂任选)制备化合物A的合成路线:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验的基本操作是完成化学实验的关键,下列实验操作正确的是( )
①用50 mL量筒量取5.2 mL稀硫酸; ②用分液漏斗分离苯和四氯化碳的混合物;
③用托盘天平称量117.7 g氯化钠晶体; ④用量筒量取23.10 mL溴水;
⑤用蒸发皿高温灼烧石灰石; ⑥用250 mL容量瓶配制250 mL 0.2 mol·L-1的NaOH溶液;
A. ③⑥ B. ②③④⑤ C. ①②④ D. ②⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com