


科目:高中化学 来源:2004全国各省市高考模拟试题汇编·化学 题型:043
(1)把一块纯净的锌片插入盛有稀硫酸的烧杯里,可观察到锌片逐渐溶解,并有气体产生,再平行地插入一块铜片,可观察到铜片上________(填“有”或“没有”)气泡产生.再用导线把锌片和铜片连接起来(如图a所示),可观察到铜片上________(填“有”或“没有”)气泡产生.
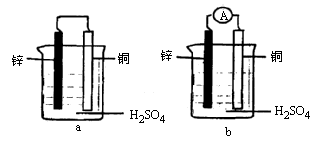
(2)用导线连接灵敏电流表的两端后,再与溶液中的锌片和铜片相连接(如图b所示),观察到灵敏电流表的指针发生了偏转,说明了导线中有电流通过.请用反应式来表示在导线中有电流通过的原因:
锌片上的反应式:________;
铜片上的反应式:________.
可见,图b是一个将化学能转化为电能的装置,人们把它叫做原电池.那么,一个正在工作着的原电池的形成条件是:________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com