
| A.2∶1 | B.5∶1 |
| C.3∶2 | D.1∶1 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.2∶1 | B.4∶1 | C.1∶1 | D.3∶1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.因为铝可失去3个电子,镁只失去2个电子,故铝比镁活泼 |
| B.铝的原子半径及离子半径均比镁的小 |
| C.铝的原子半径及离子半径均比镁的大 |
| D.镁离子、铝离子的电子结构与S2-相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1∶1 | B.1∶2 | C.1∶3 | D.2∶1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
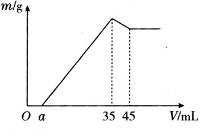
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
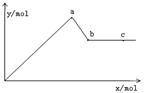
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.把镁粉投入氯化铁溶液中,常温下不会有氢气放出 |
| B.工业上通常用煅烧菱镁矿来制取氧化镁 |
| C.镁的主要用途是用于制造合金和照明弹 |
| D.食盐中如含氯化镁就易潮解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com