
【题目】在T ℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示。下列说法中不正确的是( )

A.T ℃时,在Y点和Z点,Ag2CrO4的Ksp相等
B.a=![]() ×10-5
×10-5
C.T ℃时,Ag2CrO4的Ksp为1×10-11
D.向饱和Ag2CrO4溶液中加入固体K2CrO4不能使溶液由Y点变为X点图中
【答案】B
【解析】
A. 一定温度下,溶度积是常数,温度不变,溶度积不变,该曲线为T ℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线,曲线上各点Ksp相等,则在Y点和Z点,Ag2CrO4的Ksp相等,A项正确;
B. 根据图像可得,Ksp(Ag2CrO4)=c2(Ag+)c(CrO42-)=(1×103)2×(1×105)=1×1011,Z点时c(CrO42-)=5×104,则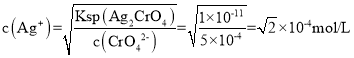 ,所以a=
,所以a=![]() ,B项错误;
,B项错误;
C. 根据B项分析得,T ℃时,Ag2CrO4的Ksp为1×10-11,C项正确;
D. 饱和Ag2CrO4溶液中存在沉淀溶解平衡:Ag2CrO4(s)2Ag+(aq)+CrO42-(aq),加入固体K2CrO4,c(CrO42-)增大,c(Ag+)减小,不能使溶液由Y点变为X点,点仍在曲线上,D项正确;
答案选B。


 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】已知常温下CH3COOH的电离常数K=1.6×10-5。向20mL0.01mol·L-1 CH3COOH溶液中逐滴加入0.01mol·L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:
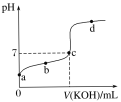
(1)写出CH3COOH的电离方程式___;
(2)c点时,所加氢氧化钾溶液的体积___20ml(填“>”“<”或“=”),b、d两点水的离子积常数的关系为kw(b)___kw(d)(填“>”“<”或“=”),滴定过程中宜选用___作指示剂,滴定终点在___(填“c点以上”或“c点以下”)。
(3)a点溶液中c(H+)约为___。
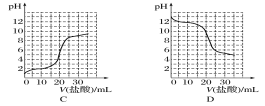
(4)若向20 mL稀氨水中逐滴加入等浓度的盐酸,则下列变化趋势正确的是____(填字母)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度
B.500℃,30MPa下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) H=-38.6kJ/mol
2NH3(g) H=-38.6kJ/mol
C.分光光度计可以用来测定某些化学反应的反应速率
D.甲烷的标准燃烧热为890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) H=-890.3kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述与下图对应的是( )




A.对于达到平衡状态的N2(g) + 3H2(g) 2NH3(g),图①表示在t0时刻充入了一定量的NH3,平衡逆向移动
B.由图②可知,p2 > p1,T1 > T2满足反应:2A(g) + B(g) 2C(g) ΔH < 0
C.图③表示的反应方程式为2A = B + 3C
D.对于反应2X(g) + 3Y(g) 2Z(g) ΔH < 0,图④y轴可以表示Y的百分含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.已知冰的熔化热为 6.0kJ·mol-1,冰中氢键键能为 20 kJ·mol-1,若熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15 %的氢键
B.在一定条件下,某可逆反应的ΔH=+100kJ·mol-1 ,则该反应正反应活化能比逆反应活化能大100 kJ·mol-1
C.甲烷的标准燃烧热为890.3 kJ·mol-1,则 1molCH4 发生反应CH4(g)+2O2(g)=CO2 (g) + 2H2O (g) 放出的热量小于 890.3 kJ·mol-1
D.500 ℃、30 MPa 下,将 0.5 mol N2 和 1.5 mol H2 置于密闭容器中充分反应生成 NH3 (g),放出量热 19.3 kJ,其热化学方程式可表示为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。部分含钒物质在水中的溶解性如下表所示:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
该工艺的主要流程如下。
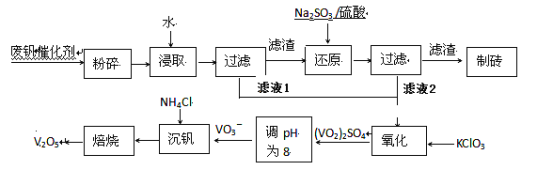
请回答下列问题:
经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如图所示。则NH4VO3在分解过程中_________。
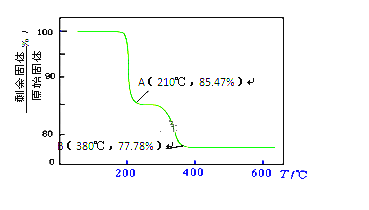
A.先分解失去H2O,再分解失去NH3 B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3 D.同时分解失去H2、N2和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) △H=-1234.8kJ·mol-1
结论:C2H5OH的燃烧热 △H=-1234.8 kJ·mol-1
B. 稀溶液中有H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ·mol-1
结论:将稀醋酸与NaOH的稀溶液混合后,若有1 mol H2O生成,则放出的能量等于57.3kJ
C. C(s,石墨)=C(s,金刚石) △H=+1.5kJ·mol-1
结论:相同条件下金刚石比石墨稳定
D. Sn(s,灰)![]() Sn(s,白) △H=+2.1kJ·mol-1(灰锡为粉末状)
Sn(s,白) △H=+2.1kJ·mol-1(灰锡为粉末状)
结论:锡制品在寒冷的冬天更容易损坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)═6CaO(s)+P4(s)+10CO(g)△H1=+3359.26 kJmol﹣1
CaO(s)+SiO2(s)═CaSiO3(s)△H2=﹣89.61 kJmol﹣1
写出白磷(P4)由Ca3(PO4)2、焦炭和SiO2在一定条件下反应的热化学方程式为:_____。
(2)电子工业中清洗硅片上的SiO2(s)的反应为SiO2(s)+4HF(g)═SiF4(g)+2H2O(g)△H(298.15 K)=﹣94.0 kJmol﹣1△S(298.15 K)=﹣75.8 Jmol﹣1K﹣1,设△H和△S不随温度而变化,此反应自发进行的温度是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列数据:
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
乙醇 | -144 | 78.0 | 0.789 |
乙酸 | 16.6 | 118 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.900 |
浓硫酸(98%) | - | 338 | 1.84 |
下图为实验室制取乙酸乙酯的装置图。
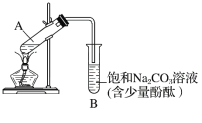
(1)当饱和碳酸钠溶液上方收集到较多液体时,停止加热,取下小试管B,充分振荡,静置。振荡前后的实验现象为________(填字母)。
A.上层液体变薄 B.下层液体红色变浅或变为无色 C.有气体产生 D.有果香味
(2)为分离乙酸乙酯、乙醇、乙酸的混合物,可按下列步骤进行分离:
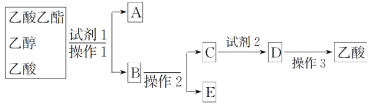
①试剂1最好选用_________________________________________________;
②操作1是________,所用的主要仪器名称是__________________________;
③试剂2最好选用_____________________________________;
④操作2是_______________________________________;
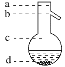
⑤操作3中温度计水银球的位置应为下图中________(填“a”“b”“c”或“d”)所示,在该操作中,除蒸馏烧瓶、温度计外 、锥形瓶 ,还需要的玻璃仪器有__________、________、________,收集乙酸的适宜温度是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com