
【题目】细胞中常见的化学元素有20多种,其中有些含量较多,称为大量元素;有些含量很少,称为微量元素。下列各组元素中,全是微量元素的是
A.Fe、Mn、B、Mo、SB.C、H、O、Ca、Mg
C.P、N、K、Ca、MgD.Mo、Zn、Cu、B、Fe
科目:高中化学 来源: 题型:
【题目】下列说法不能够用勒夏特勒原理来解释的是
A. 实验室用排饱和食盐水的方法收集氯气
B. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后(AgBr是淡黄色沉淀),溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后(AgBr是淡黄色沉淀),溶液颜色变浅
C. SO2催化氧化制SO3的过程中使用过量的氧气,以提高二氧化硫的转化率
D. 恒温、恒压条件下,在2NO2![]() N2O4平衡体系中充入He后,体系颜色变浅
N2O4平衡体系中充入He后,体系颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期第V A族元素,用化学用语回答问题:
(1)砷的最高价氧化物对应的水化物化学式是 _________,气态氢化物的稳定性ASH3________(填写“大于”或“小于”)NH3。
(2)砷在自然界中主要以硫化物形式(如雄黄As4S4、雌黄As2S3等)存在。雄黄和雌黄的转换关系如图1所示:
①气体物质a是 _____________(填化学式)。
②第I步反应的离子方程式是_________________________________。

(3)Na2HAsO3溶液呈碱性,原因是_______________(用离子方程式表示),该溶液中c(H2AsO3-)______ c(AsO33-) (填“>”、“<”或“=”)。
(4)某原电池装置如图2所示,电池总反应为AsO43-++2I-+H2O![]() AsO33-+I2+ 2OH-。当P池中溶液由无色变蓝色时,正极上的电极反应式为_________;当电流计指针归中后向Q中加入一定量的NaOH,电流计指针反向偏转,此时P中的反应式是__________________。
AsO33-+I2+ 2OH-。当P池中溶液由无色变蓝色时,正极上的电极反应式为_________;当电流计指针归中后向Q中加入一定量的NaOH,电流计指针反向偏转,此时P中的反应式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对达到平衡状态的可逆反应:A+B![]() C+D,在t1时增大压强,则正、逆反应速率变化如图所示(v表示反应速率,t代表时间),下列有关A、B、C、D的状态叙述正确的是
C+D,在t1时增大压强,则正、逆反应速率变化如图所示(v表示反应速率,t代表时间),下列有关A、B、C、D的状态叙述正确的是
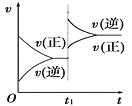
A. A、B、C是气体,D不是气体
B. A、B是气体,C、D有一种是气体
C. C、D是气体,A、B有一种是气体
D. C、D有一种是气体,A、B都不是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从淡化海水中提取溴的流程如下:

下列有关说法不正确的是
A. X试剂可用Na2SO3饱和溶液
B. 步骤Ⅲ的离子反应:2Br-+Cl2=2Cl-+Br2
C. 工业上每获得1molBr2,需要消耗Cl244.8L
D. 步骤Ⅳ包含萃取、分液和蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 某实验小组对H2O2的分解做了如下探究。下表是研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 mL5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
块状 | 微热 | 反应较慢,火星红亮,但木条未复燃 | 30min |
(1)该反应是_________反应(填放热或吸热)。
(2)实验结果表明,催化剂的催化效果与_____________________有关。
Ⅱ.某可逆反应在体积为5L的密闭容器中进行,在从0—3分钟各物质的物质的量变化情况如图所示(A、B、C均为气体)。
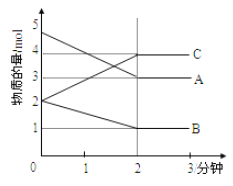
(3)该反应的的化学方程式为_____________。
(4)反应开始至2分钟时,B的平均反应速率为__________。
(5)能说明该反应已达到平衡状态的是_________。
A.v(A)= 2v(B) B.容器内压强保持不变
C.v逆(A)= v正(C) D.容器内混合气体的密度保持不变
(6)由图求得A的平衡时的转化率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、R四种短周期元素,Y、Z、R同周期。相关信息如下:
相关信息 | |
X | 单质为双原子分子。若低温蒸发液态空气,因其沸点较低可先获得X的单质 |
Y | 含Y元素的物质焰色反应为黄色 |
Z | 同周期元素中原子半径最小 |
R | R元素原子的最外层电子数是K层电子数的3倍 |
(1)Z元素在周期表的位置是_____,Y、Z、R简单离子的半径从大到小的顺序是__________(用离子符号表示);
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构。甲遇水蒸气可形成一种常见的漂白性物质。则甲的结构式为 ___________;
(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色。则Y2R2的电子式为_______,写出乙溶液在空气中变质过程的化学方程式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中通入一定量的A、B,发生反应A(g)+2B(g)![]() 3C(g)。如图是A的反应速率v(A)随时间变化的示意图。下列说法正确的是( )
3C(g)。如图是A的反应速率v(A)随时间变化的示意图。下列说法正确的是( )

A.反应物A的浓度:a点小于b点
B.该反应的某种生成物可能对反应起催化作用
C.曲线上的c、d两点都表示达到平衡状态
D.A的平均反应速率:ab段大于bc段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中无机氮的循环过程可用如图表示。下列说法正确的是(已知:反应④的离子方程式为4NH4+ + 5O2![]() 2NO2- + 6H+ + N2O + 5H2O)
2NO2- + 6H+ + N2O + 5H2O)

A. ①②均属于固氮反应
B. 海洋中的反硝化作用一定需要氧气参加
C. 反应④中每生成1 mol H2O转移2 mol e-
D. 向海洋排放含NO3-的废水可能影响海洋中氮的循环
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com