
| A. | 0~60 s,以X的浓度变化表示的反应速率为0.001 mol•L-1•s-1 | |
| B. | 将容器体积变为20 L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 若增大压强,则物质Y的转化率减小 | |
| D. | 若升高温度,X的体积分数增大,则该反应的△H>0 |
分析 A.先计算出60s内用Z表示的反应速率,然后利用化学计量数关系计算出60s内以X浓度变化表示的反应速率;
B.容器体积增大一倍,容器内压强实现,平衡向着逆向移动,则Z的浓度大于原先的一半;
C.增大压强,平衡向着正向移动,Y的转化率增大;
D.升高温度后,平衡向着吸热的反应方向一定,X的体积分数增大,则平衡向着逆向移动,逆反应为吸热反应.
解答 解:A.达到平衡时Z的平均反应速率为:v(Z)=$\frac{\frac{0.3mol}{10L}}{60s}$=0.0005mol/(L•s),反应速率与化学计量数成正比,则60s内以X浓度变化表示的反应速率为:v(X)=2v(Z)=0.001 mol/(L•s),故A正确;
B.将容器容积变为20L时,物质的压强减小,平衡向体积增大的方向移动,即逆向移动,Z的物质的量减小,即小于0.3mol,Z的新平衡浓度将小于原平衡浓度的$\frac{1}{2}$,故B错误;
C.增大压强后,平衡向着正反应方向移动,则Y的转化率增大,故C错误;
D.若升高温度,X的体积分数增大,说明逆反应为吸热反应,则正反应为放热反应,△H<0,故D错误;
故选A.
点评 本题主要考查化学平衡的影响及其应用,题目难度中等,明确化学平衡及其影响因素为解答关键,注意掌握化学反应速率的概念及表达式,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用V(X)和V(Y)表示此反应的反应速率是:V(X)=V(Y)=(0.1-0.2a)mol•(L•min)-1 | |
| B. | 当混合气体的质量不再发生变化时,说明反应达到平衡状态,此时气体总量为(1+n)mol | |
| C. | 若建立平衡I的起始时n=1,维持温度和体积不变,向平衡I的体系中再加入cmolZ和dmolM[其中c>0的任意值,d≥(1-a)mol],达到平衡状态II,此时Y的体积分数一定为w% | |
| D. | 维持温度和体积不变,向上述平衡体系中再充入l mol X和n mol Y,此时v(正)增大,v(逆)减小,平衡正向移动,再次达到平衡时,Z的物质的量浓度为2a mol/L,M的物质的量为2a mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
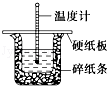 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在图示的装置中进行中和反应,通过测定反应过程中的热量可计算中和热,回答下列问题:
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在图示的装置中进行中和反应,通过测定反应过程中的热量可计算中和热,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数B>A>C | B. | 原子最外层电子数C>A>B | ||
| C. | 原子半径A>C>B | D. | 离子半径A+>B2->C3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
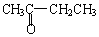
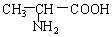 与
与
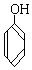 与
与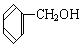
 与
与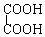
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com