
����Ŀ��A��B��C��D��E��FΪԭ��������������Ķ���������Ԫ�أ�A��Fԭ�ӵ�����������������������������Fԭ�ӵĵ��Ӳ�����A��3����Bԭ�Ӻ�����ӷִ�3����ͬ�ܼ���ÿ���ܼ��ϵĵ�������ͬ��A��C�γɵķ���Ϊ�����Σ�Dԭ��p����ϳɶԵĵ�����������δ�ɶԵĵ���������Eԭ�Ӻ���ÿ��ԭ�ӹ���ϵĵ��Ӷ��ѳɶԣ�E�縺��С��F��
��1��A��C�γɵķ��Ӽ�������ˮ����÷��ӻ�Ϊ�ȵ������������Ϊ ��
��2���Ƚ�E��F�ĵ�һ�����ܣ�E�������������F��
��3��BD2�ڸ��¸�ѹ�����γɵľ�����ͼ��ʾ���þ������������������ӡ���ԭ�ӡ������ӡ������������壬�þ�����Bԭ�ӵ��ӻ���ʽΪ �� 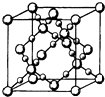
��4������F��ǿ����Һ��Ӧ��[F��OH��4]�����ɣ���[F��OH��4]���д���������ĸ���� a�����ۼ� b���Ǽ��Լ� c����λ�� d���Ҽ� e���м�
��5��Cu���������������壬�������ÿ����5��Cuԭ�ӽ��ܶ�������֪ÿ��Cuԭ�ӵ�����Ϊa g��Cuԭ�Ӱ뾶Ϊd cm����þ�����ܶ�Ϊgcm��3 �� ���ú�a��d�Ĵ���ʽ��ʾ��
���𰸡�
��1��H3O+
��2����
��3��ԭ�Ӿ��壻sp3
��4��acd
��5��![]()
���������⣺A��B��C��D��E��FΪԭ��������������Ķ���������Ԫ�أ�A��Fԭ�ӵ�����������������������������Fԭ�ӵĵ��Ӳ�����A��3������AΪ��Ԫ�أ�FΪ��Ԫ�أ�Bԭ�Ӻ�����ӷִ�3����ͬ�ܼ���ÿ���ܼ��ϵĵ�������ͬ����B�ĺ�������Ų�Ϊ1s22s22p2 �� BΪ̼Ԫ�أ�A��C�γɵķ���Ϊ�����Σ���C��ԭ����������B��F֮�䣬����CΪ��Ԫ�أ�Dԭ��p����ϳɶԵĵ�����������δ�ɶԵĵ�����������p�������4�����ӣ�����D��ԭ������С��F������D�ĺ�������Ų�Ϊ1s22s22p4 �� ����DΪ��Ԫ�أ�Eԭ�Ӻ���ÿ��ԭ�ӹ���ϵĵ��Ӷ��ѳɶԣ�E�縺��С��F����ԭ������С��F������EΪþԪ�أ���1��A��C�γɵķ��Ӽ�������ˮ�������ʽΪNH3 �� ���ݵȵ�����ԭ�����۵��Ӻ�ԭ����Ҫ�ֱ���ȣ�����д�����以Ϊ�ȵ������������Ϊ��H3O+ �� ���Դ��ǣ�H3O+����2��Mg��AlԪ�ض��ǵڶ����ڽ���Ԫ�أ�ͬһ����Ԫ��������ҵ�һ�����ܳ��������ƣ���MgԪ��ԭ��3S�ܼ��dz���״̬�������ϵͣ���һ�����ܸ���ͬ��������Ԫ�أ����Ե�һ������Mg��Al�����Դ��ǣ�������3������CO2�ڸ��¸�ѹ�����γɵľ����Ľṹͼ��֪���þ�������̼ԭ������ԭ��ֱ�ӹ��ɣ�̼ԭ������ԭ��֮��ͨ�����ۼ����ã��������־���Ϊԭ�Ӿ��壬ÿ��̼ԭ����Χ�����ĸ�C��O��������Cԭ�ӵĹ���ӻ���ʽΪsp3 �� ���Դ��ǣ�ԭ�Ӿ��壬sp3����4����[Al��OH��4]���У�������������������֮������λ�����ã����������ڲ������ż��Թ��ۼ�����Щ���ۼ����ǵ�����Ҳ���Ƕ��ǦҼ����ݴ��ж�acd��ȷ�����Դ��ǣ�acd����5��ͭ��������������������ÿ��ͭ�����к��е�ԭ�Ӹ���=8�� ![]() +6��
+6�� ![]() =4���������ÿ����5��Cuԭ�ӽ��ܶ�����Cu��ԭ�Ӱ뾶Ϊd cm���������������Խ��߳���Ϊ4dcm�����Ծ����ı߳�Ϊ
=4���������ÿ����5��Cuԭ�ӽ��ܶ�����Cu��ԭ�Ӱ뾶Ϊd cm���������������Խ��߳���Ϊ4dcm�����Ծ����ı߳�Ϊ ![]() ��4dcm=
��4dcm= ![]() dcm�����Ծ�����ܶ�
dcm�����Ծ�����ܶ� ![]() g/cm3=
g/cm3= ![]() g/cm3 �� ���Դ��ǣ�
g/cm3 �� ���Դ��ǣ� ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D������ѧ��ѧ�г������л������������һ����������������ת����ϵ���������ʺ���������ȥ�������У�A�����ϩ��������ʽΪC2H4 �� ���������������һ������ʯ�ͻ�����չ��ˮƽ��C�������г��õ�һ�־�����ζ�ĵ�ζƷ�ijɷ֣�ͨ��״���£�D�Ǿ���Ũ����ζ����״Һ�壮 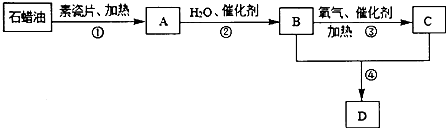
��1�����л�������A��B��C��D�У����������������ṹ��ʽ������Ӧ�ܵķ�Ӧ������ ��
��2����A��B��C��D�У��ܶȱ�ˮС��������ˮ��Һ���������������ƣ���A��һ�������¿��Է����Ӿ۷�Ӧ����һ�����ϣ������ϵĽṹ��ʽΪ ��
��3����Ӧ���У��ش�Ƭ����Ҫ������ �� һ�������£� B��C��D���������в��ܺ�NaOH��Һ��Ӧ������Ӧ���������������ƣ���
��4��ֲ��ո���һ����������ˮ��������ǣ��������ھƻ�ø����������ת��ΪB��B��ij����������·���������Ӧ�õ�C��д��������ת��ΪB�Ļ�ѧ����ʽ�� ��
��5����ʵ���һ�õ�D����������������B��C��Ϊ�ᴿD�������Ƚ��˲�����D��һ��ֻ�ϣ�Ȼ���پ��á�����������ƣ����ɣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Xn��������N����X��������ΪA����ag X���⻯���к����ӵ����ʵ����ǣ� ��
A. ��N��a��mol B. ![]() ��n+A��mol
��n+A��mol
C. ![]() ��N+n��mol D.
��N+n��mol D. ![]() ��A��N+n��mol
��A��N+n��mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ӽ��д���
A.ֻ�о������B.ֻ�о�������
C.���Ӽ�������D.�����������г���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����¯�����з����Ļ�����Ӧ֮һ���£�FeO��s��+CO��g��Fe��s��+CO2��g��������Ӧ�����ȷ�Ӧ������ƽ�ⳣ���ɱ�ʾΪK= ![]() ����֪1100��ʱK=0.263
����֪1100��ʱK=0.263
��1���¶����ߣ���ѧƽ���ƶ���ﵽ�µ�ƽ�⣬��¯��CO2��CO�������ֵ��ƽ�ⳣ��Kֵ��ѡ�������С�����䡱��
��2��1100��ʱ��ø�¯��c��CO2��=0.025molL��1��c��CO��=0.1molL��1 �� ����������£��÷�Ӧ�Ƿ��ڻ�ѧƽ��״̬��ѡ��ǡ�������ʱ����ѧ��Ӧ������v������v���棩��ѡ����ڡ���С�ڡ����ڡ�������ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ���о�Ԫ�����ʵݱ����ʵ��ʱ���Լ������һ��ʵ�鷽��������¼���й�ʵ������(���±������е���ʵ�鷽��������ʵ��������ǰ��һ���Ƕ�Ӧ��ϵ)��
ʵ�鲽�� | ʵ������ |
����þ����ɰֽ��ĥ�����Թ��У���������ˮ������ˮ���ڣ�������Һ�еμӷ�̪��Һ | A.����ˮ���ϣ��۳�С���Ĵ��ζ���������˻˻��������֮��ʧ����Һ��ɺ�ɫ |
�������Ƶ�Na2S��Һ�еμ����Ƶ���ˮ | B.�������������Һ���dz��ɫ |
����һС������Ʒ�����з�̪��Һ����ˮ�� | C.���ҷ�Ӧ��Ѹ�ٲ���������ɫ���� |
����þ��Ͷ��ϡ������ | D.��Ӧ��ʮ�־��ң�������ɫ���� |
��������Ͷ��ϡ������ | E.���ɰ�ɫ��״�������̶�������ʧ |
����AlCl3��Һ�еμ�NaOH��Һ������ | F.���ɵ���ɫ���� |
���������ͬѧ���������ʵ�鱨�档
��1��ʵ��Ŀ�ģ��о�__________________Ԫ�����ʵݱ���ɡ�
��2��ʵ����Ʒ���Լ��������ơ�þ����������ϡ���ᡢ������ˮ������Na2S��Һ��AlCl3��Һ��NaOH��Һ����̪��Һ�ȡ�
������________��________����ֽ���ԹܼС���ͷ�ιܡ����ӡ��ձ���С��������Ƭ��ɰֽ�����ȡ�
��3��ʵ�����ݣ�(��д��ʵ�鲽���Ӧ��ʵ������ı�ź��٢��Ļ�ѧ����ʽ����ʵ��Ľ���)
ʵ������ | �� | �� | �� | �� | �� | �� |
ʵ������(��A��F) | ____ | ____ | __ | ____ | ____ | ____ |
��_________________________________________________��
��_____________________________________________��
��ʵ��Ľ��ۣ�________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ֪ʶ���������Ŀ��
��1��X��̬ԭ�ӵ�M����K���������ȣ���X���������е�һ����������Ԫ���� ��
��2����Y2+���ӵ�3d�������9�����ӣ���̬Yԭ�ӵļ۵����Ų�ʽΪ
�ڽ�Y��ĩ����NH3��Ũ��Һ�У�ͨ��O2 �� ��ַ�Ӧ����Һ������ɫ���������·�Ӧ��
2Y+8NH3H2O+O2=2[Y��NH3��4]��OH��2+6H2O���ù������γɵĻ�ѧ��������
a������ b���Ӽ� c���Լ� d�Ǽ��Լ� e��λ�� f��� g���»���
��3��K2Cr2O7��һ�ֳ�����ǿ�����������������»ᱻ��ԭ����ԭ��Cr3+ �� Cr3+����OH����CN���γ������[Cr��OH��4]����[Cr��CN��6]3�� ��
�ٲ����ǿռ乹�ͣ�[Cr��OH��4]���Ľṹ����ʾ��ͼ��ʾΪ��������λ�����ü��ű�ʾ��
��һ��������������LaCrO3�ľ�����ͼ1��ʾ����֪����ÿ��Crԭ�������Oԭ����6������ͼ��ԭ�Ӵ�������Crԭ�ӣ���A��B��C����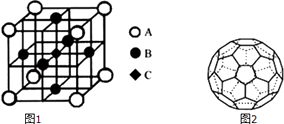
��4��̼��һ�ֵ��ʽṹ��ͼ2��ʾ������Է�������Ϊ720�����ӹ���Ϊһ��32���壬������12����Ԫ����20����Ԫ������õ�����̼ԭ�ӵ��ӻ���ʽ�� �� 1mol�õ����д��ڵĦм���ĿΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�ΪԪ�����ڱ���һ���֣������Ԫ�آ٩����ڱ��е�λ�ã��û�ѧ����ش��������⣺ 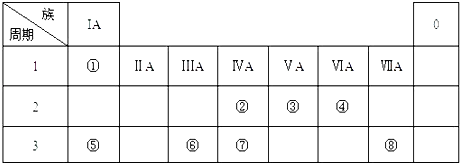
��1���ܡ��ݡ���ԭ�Ӱ뾶�ɴ�С��˳��Ϊ ��
��2���ڡ��ࡢ�ߵ���ۺ������������ǿ������˳���� ��
��3���۵���̬�⻯��ĵ���ʽ ��
��4���ݵ�����������Ӧˮ�������Һ�뵥�ʢޡ����ʢ�ֱ�Ӧ�����ӷ���ʽ�� ��
��5�����ʢ��ڵ��ʢ���ȼ�գ�����Ϊɫ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com