
| A. | 反应开始时的速率:甲<乙 | |
| B. | 反应开始时,酸的物质的量浓度:甲>乙 | |
| C. | 反应开始时,酸的物质的量浓度:甲<乙 | |
| D. | 反应所需时间:甲<乙 |
分析 pH相同的盐酸(甲)和醋酸(乙),则两种溶液中氢离子浓度相等,反应速率和离子浓度成正比,醋酸是弱电解质,氯化氢是强电解质,所以c(HCl)<c(CH3COOH);若最后锌粒全部溶解且放出气体一样多,可能是盐酸恰好反应而醋酸过量,也可能是盐酸和醋酸都过量,据此分析解答.
解答 解:A.pH相同的盐酸(甲)和醋酸(乙),两种溶液中氢离子浓度相等,所以开始反应速率相等,故A错误;
B.pH相同的盐酸(甲)和醋酸(乙),醋酸是弱电解质,氯化氢是强电解质,所以c(HCl)<c(CH3COOH),故B错误;
C.pH相同的盐酸(甲)和醋酸(乙),醋酸是弱电解质,氯化氢是强电解质,所以c(HCl)<c(CH3COOH),故C正确;
D.随着反应的进行,醋酸继续电离出氢离子,导致醋酸溶液中氢离子浓度大于盐酸,氢离子浓度越大,其反应速率越快,所以醋酸反应速率大于盐酸,则反应所需时间:甲>乙,故D错误;
故选C.
点评 本题考查了弱电解质的电离,根据影响反应速率的因素、弱电解质电离特点、物质的性质等知识点来分析解答,反应速率与离子浓度有关,与电解质强弱无关,为易错点.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | N-H键键能的含义是把1molNH3中的共价键全部拆开所吸收的能量 | |
| B. | ClO-的空间构型为平面三角形 | |
| C. | 卤素单质从F2到I2,在常温常压下的聚集状态由气态、液态到固态的原因是原子半径逐渐增大 | |
| D. | 熔点由高到低的顺序为:金刚石>MgO>NaCl>CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
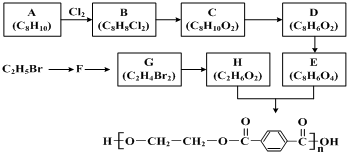
 ;
; (写出结构简式).
(写出结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,新戊烷的结构简式为C(CH3)4.
,新戊烷的结构简式为C(CH3)4.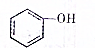 (填“>”、“<”或“=”,下同)
(填“>”、“<”或“=”,下同)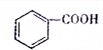 (提示:类比醇与酚的酸性)
(提示:类比醇与酚的酸性) .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ③
③ ⑤
⑤ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2项 | B. | 3项 | C. | 4项 | D. | 5项 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
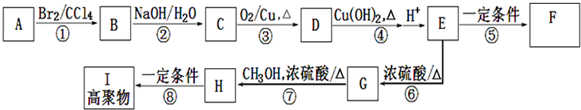
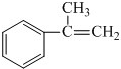 ;E在一定条件下能形成3个六元环的物质,该物质的结构简式为:
;E在一定条件下能形成3个六元环的物质,该物质的结构简式为: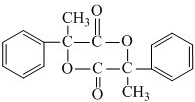 .
.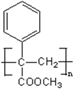 .
.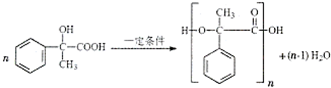 .
.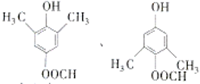 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol•L碳酸钠溶液中,阴离子数目小于0.1NA | |
| B. | 0.lmol铁粉与足量水蒸气反应生成的H2分子数目为0.1NA | |
| C. | 常温常压下,6g乙酸所含共价键数目为0.7NA | |
| D. | 1mol苯和苯甲酸的混合物完全燃烧时消耗O2的分子数为7.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
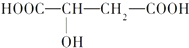
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com