

 .
.
 ,A→B的反应类型是取代反应.
,A→B的反应类型是取代反应. )反应,除生成
)反应,除生成 外,同时生成的另一种产物的结构简式是CH3COOH.
外,同时生成的另一种产物的结构简式是CH3COOH. 互为同分异构体,且具有以下特点:
互为同分异构体,且具有以下特点:分析 (1)A.双香豆素不含酚羟基;
B.含有苯环的烃属于芳香烃,仅含C、H两种元素;
C.由结构可知,分子中均含有酯基;
D.1mol香豆素含1mol碳碳双键;
(2)香豆素水解得到羧基、酚羟基均与氢氧化钠发生中和反应;
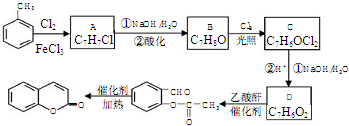
(3)甲苯与氯气在氯化铁作催化作用下发生苯环上取代反应生成A,A发生卤代烃的水解反应得到B,B在光照条件下与氯气发生甲基上取代反应生成C,C在发生卤代烃水解反应、酸化得到D,D中含有-CHO、酚羟基,D与乙酸酐反应生成 ,发生取代反应,还生成乙酸,可知D为
,发生取代反应,还生成乙酸,可知D为 ,则C为
,则C为 、B为
、B为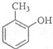 、A为
、A为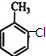 .
.
解答 解:(1)A.双香豆素不含酚羟基,不能与FeCl3溶液发生显色反应,故A错误;
B.含有苯环的烃属于芳香烃,仅含C、H两种元素,二者均含有元素,不属于芳香烃,故B错误;
C.由结构可知,分子中均含有酯基,故C正确;
D.1mol香豆素含1mol碳碳双键,含碳碳双键数为NA,故D错误,
故选:C;
(2)香豆素水解得到羧基、酚羟基均与氢氧化钠发生中和反应,反应方程式为: ,
,
故答案为: ;
;
(3)甲苯与氯气在氯化铁作催化作用下发生苯环上取代反应生成A,A发生卤代烃的水解反应得到B,B在光照条件下与氯气发生甲基上取代反应生成C,C在发生卤代烃水解反应、酸化得到D,D中含有-CHO、酚羟基,D与乙酸酐反应生成 ,发生取代反应,还生成乙酸,可知D为
,发生取代反应,还生成乙酸,可知D为 ,则C为
,则C为 、B为
、B为 、A为
、A为 .
.
①A为 ,名称是2-氯甲苯,C的结构简式是
,名称是2-氯甲苯,C的结构简式是 ,A→B的反应类型是:取代反应,
,A→B的反应类型是:取代反应,
故答案为:2-氯甲苯; ;取代反应;
;取代反应;
②D为 ,含有的官能团名称是:醛基、羟基,D与乙酸酐(
,含有的官能团名称是:醛基、羟基,D与乙酸酐( )反应,除生成
)反应,除生成 外,同时生成的另一种产物的结构简式是:CH3COOH,
外,同时生成的另一种产物的结构简式是:CH3COOH,
故答案为:醛基、羟基;CH3COOH;
③与 互为同分异构体,且具有以下特点:(a)含有苯环 (b)能发生银镜反应,说明含有醛基,(c)与NaHCO3溶液反应可放出气体,说明含有-COOH,含有一个侧链为-CH(CHO)COOH,可以含有2个侧链为-CH2COOH、-CHO,或者-CH2CHO、-COOH,各有邻、间、对3种,可以含有3个侧链为-CH3、-COOH、-CHO,当-CH3、-COOH处于邻位时、-CHO有4种位置,当-CH3、-COOH处于间位时、-CHO有4种位置,
互为同分异构体,且具有以下特点:(a)含有苯环 (b)能发生银镜反应,说明含有醛基,(c)与NaHCO3溶液反应可放出气体,说明含有-COOH,含有一个侧链为-CH(CHO)COOH,可以含有2个侧链为-CH2COOH、-CHO,或者-CH2CHO、-COOH,各有邻、间、对3种,可以含有3个侧链为-CH3、-COOH、-CHO,当-CH3、-COOH处于邻位时、-CHO有4种位置,当-CH3、-COOH处于间位时、-CHO有4种位置,
当-CH3、-COOH处于对位时、-CHO有2种位置,故符合条件的同分异构体共有17种,
故答案为:17.
点评 本题考查有机物的推断与合成、官能团的结构与性质、限制条件同分异构体书写、有机反应类型、有机物命名等,注意根据反应条件、有机物分子式与反应信息进行推断,侧重于学生的分析能力和推断能力的考查,同分异构体书写为易错点,注意利用“定二移一”书写苯环三元取代,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 铁能被磁体吸引,纯铁易生锈 | |
| B. | FeCl2可以通过铁与氯气的化合反应得到 | |
| C. | 缺铁性贫血里的铁是指铁元素 | |
| D. | 工业上常用铁矿石与氢气在高炉内反应来炼铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH的燃烧热为1452kJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O(g)△H>-571.6kJ•mol-1 | |
| C. | 2CH3OH(l)+O2(g)═2CO2(g)+4H2(g)△H=-880.4kJ•mol-1 | |
| D. | CH3COOH(aq)+NaOH(aq)═H2O(l)+CH3COONa(aq)△H=-57.3kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
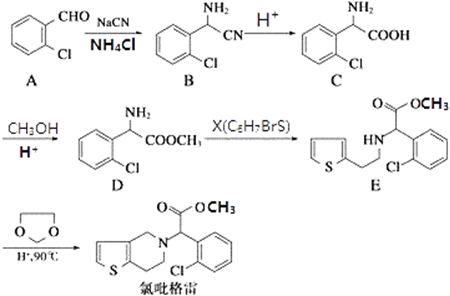

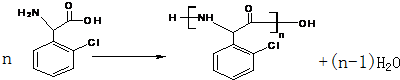 .(不需要写反应条件)
.(不需要写反应条件) ②
②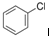 中氯原子较难水解,物质A(
中氯原子较难水解,物质A(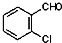 )可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式
)可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式 、
、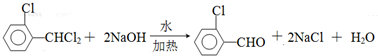 .
.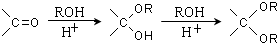
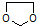 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2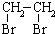
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作过程 | 实验现象 |
| 将干燥纯净的CO2缓缓通过放有钠的已排尽空气的干燥玻璃管中,加热 | 钠燃烧,火焰为黄色 |
| 反应后冷却 | 管壁附有黑色颗粒和白色物质 |
| 实验步骤 | 实验现象 |
| ①少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加过量的CaC12溶液出现白色沉淀 | 出现白色沉淀 |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
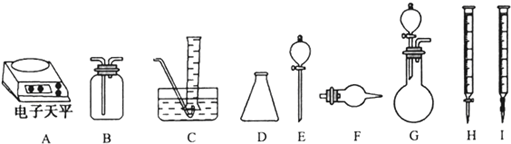
| 实验过程中发生反应的化学方程式 | 实验所需仪器(用字母表示) | 实验所需试剂(用字表示) | 实验需直接测定的有关物理量(用文字说明) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>b>c | B. | b>a>c | C. | c>b>a | D. | b>c>a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com