
| A. | 碱性氧化物一定是金属氧化物 | |
| B. | Na2O、Na2O2组成元素相同,阳离子与阴离子个数比也相同 | |
| C. | Na2O2、HClO、SO2等物质都具有漂白作用 | |
| D. | 共价化合物固态时不导电,熔融态时导电 |
分析 A、和酸反应生成盐和水的氧化物为碱性氧化物,一定是金属氧化物;
B、氧化钠是钠离子和氧离子构成,过氧化钠是钠离子和过氧根离子构成;
C、过氧化钠、,次氯酸具有氧化性,能漂白有色物质,二氧化硫具有漂白作用,选择性漂白某些有色物质;
D、共价化合物熔融状态不能电离出离子,不能导电.
解答 解:A、碱性氧化物都是金属氧化物,但金属氧化物不一定是碱性氧化物,如Mn2O7,故A正确;
B、氧化钠是钠离子和氧离子构成,过氧化钠是钠离子和过氧根离子构成,阳离子与阴离子个数比为2:1,离子个数比相同,故B正确;
C、过氧化钠、,次氯酸具有氧化性,能漂白有色物质,二氧化硫具有漂白作用,选择性漂白某些有色物质,都具有漂白作用,故C正确;
D、共价化合物熔融状态不能电离出离子,不能导电,只有在水溶液中电离出离子能导电,故D错误;
故选D.
点评 本题考查了物质分类的方法和依据,注意物质的组成和分析判断,掌握基础是解题关键,题目较简单.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 制备水杨酸对正辛基苯基酯(
制备水杨酸对正辛基苯基酯( )如下:
)如下: (水杨酸)+SOCl2→
(水杨酸)+SOCl2→ (水杨酰氯)+HCl↑+SO2↑
(水杨酰氯)+HCl↑+SO2↑ ],温度控制在100℃左右,不断搅拌.
],温度控制在100℃左右,不断搅拌. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q与W能形成10电子,不能形成14电子、18电子分子 | |
| B. | Y的最高价氧化物对应水化物的化学式只能表示为H4YO4 | |
| C. | Y、Z、Q分别与X化合,只能形成AB2型化合物 | |
| D. | X、Z、W三种元素形成的两种钠盐溶液发生化学反应生成的气体可使品红溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 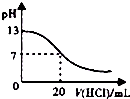 如图表示室温时,用0.1 mol.L-1 盐酸滴定0.1 mol•L-1NaOH溶液过程中的pH变化 | |
| B. | 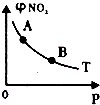 T℃时,反应2NO2(g)  N2O4(g)达到平衡时NO2的体积分数φ(NO2)随压强P的变化如图所示,则A点的颜色深,B点的颜色浅 N2O4(g)达到平衡时NO2的体积分数φ(NO2)随压强P的变化如图所示,则A点的颜色深,B点的颜色浅 | |
| C. | 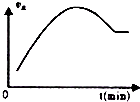 如图表示向绝热恒容密闭容器中通入A2和B2,一定条件下使反应2A2(g)+B2(g)?2C(g)达到平衡,正反应速率随时间变化的示意图.由图可得出的结论是:反应物的总能量低于生成物的总量 | |
| D. | 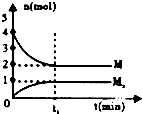 如图在恒温恒容的密闭容器中,气体M存在如下关系xM(g)?Mx(g),t1时刻,保持温度不变,再充入1mol M,重新达到平衡时$\frac{c(Mx)}{c(M)}$将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
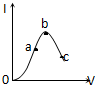 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示,下列叙述正确的是( )
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示,下列叙述正确的是( )| A. | a、b、c三点处,溶液c(H+)由小到大的顺序为a、b、c | |
| B. | a、b、c三点处,电离程度最大的是b | |
| C. | a、b、c三点处,c(CH3COO-)最大的是c | |
| D. | 若使c点溶液中c(CH3COO-)增大,可采取的措施有加入NaOH固体或加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗中的上层液体应由上口倒出 | |
| B. | 用NaOH固体配制100mL 1mol•L-1的氢氧化钠溶液时,用到的玻璃仪器主要有玻璃棒、烧杯、量筒、胶头滴管、100mL容量瓶 | |
| C. | 配制一定物质的量浓度溶液过程中,玻璃棒的作用主要是搅拌和引流 | |
| D. | 容量瓶在使用前要检查是否漏水,若瓶内残留蒸馏水会导致所得溶液浓度偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=2的硫酸溶液中c(H+):c(OH-)等于2:1,稀释100倍后二者的比值几乎不变 | |
| B. | 由水电离的c(H+)=10-12mol/L的溶液中:K+、Ba2+、Cl-、Br-、一定能大量共存 | |
| C. | 1.0×10-3mol/L盐酸溶液的pH=3,则1.0×10-8mol/L盐酸溶液的pH=8 | |
| D. | 某温度下水的离子积为1.0×10-12,若使pH=1的H2SO4溶液与pH=12的NaOH溶液混合后溶液呈中性,则两者的体积比为10:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com