
【题目】(1)①25℃时,NaHCO3溶液呈碱性,原因是___________水解引起的(填“Na+”或“HCO3-”);
②常温下,0.0100mol/L 盐酸的pH=___________;
③用0.0100mol/L 盐酸滴定未知浓度的NaOH溶液,酚酞作指示剂,滴定终点时,溶液的颜色由浅红色变为___________(填“蓝色”或“无色”),且半分钟内保持不变。
(2)①已知H2与O2反应生成1mol H2O(g)时放出241.8kJ 的热量,请完成该反应的热化学方程式:2H2(g) +O2(g)=2H2O(g) △H=___________kJ/mol;
②已知:C(石墨,s)=C(金刚石,s) △H>0,则稳定性: 石墨___________金刚石 (填“>”、“<”或“=”)。
(3)在某密闭容器中进行可逆反应:FeO(s)+CO(g)![]() Fe(s)+CO2(g) △H>0,平衡常数表达式为K=
Fe(s)+CO2(g) △H>0,平衡常数表达式为K=![]() 。
。
①反应达到平衡后,向容器中通入CO,化学平衡向__________方向移动(填“正反应”或“逆反应”);
②若升高温度,平衡常数K___________(填“增大”、“减少”或“不变”);
③查阅资料得知1100℃时K=0.263。某时刻测得容器中c(CO2)=0.025 mol/L,c(CO)=0.10 mol/L,此时刻反应__________平衡状态(填“达到”或“未达到”)。
(4)电化学是研究化学能与电能相互转化的装置、过程和效率的科学。
①根据氧化还原反应:2Ag+(aq)+Cu(s)=2Ag(s)+Cu2+(aq),设计的原电池如图一所示,X溶液时__________溶液(填“CuSO4”或“AgNO3”);
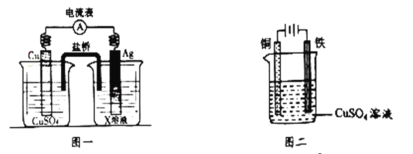
②图二装置在铁件上镀铜,铁作阴极,则铜极上的电极反应是___________。
【答案】HCO3- 2 无色 -483.6 > 正反应 增大 未达到 AgNO3 Cu-2e-=Cu2+
【解析】
(1)根据盐类水解原理分析解答;根据pH计算表达式进行计算;根据滴定原理及指示剂的变色范围分析解答;(2)根据反应热与反应物物质的量的关系分析解答;(3)根据平衡常数表达式及平衡移动原理分析解答;(4)根据原电池原理及电解池原理分析解答。
(1)①在溶液中,强碱弱酸盐,强酸弱碱盐或弱酸弱碱盐电离出来的离子与水电离出来的H+与OH-生成弱电解质的过程叫做盐类水解,所以能发生水解反应的是HCO3-,故答案为:HCO3-;
②盐酸属于强电解质,完全电离,c(H+)=c(HCl)=0.0100mol/L,pH=-lgc(H+)=-lg10-2=2,故答案为:2;
③酚酞在碱性溶液中为红色,当达到滴定终点时溶液为中性,所以溶液变为无色,故答案为:无色;
(2)①反应热和参加反应的反应物物质的量成正比,则H2与O2反应生成2mol H2O(g)时放出的热量为241.8kJ×2=483.6kJ,则热化学方程式为:2H2(g) +O2(g)=2H2O(g) △H=-483.6kJ kJ/mol,故答案为:-483.6;
②由C(石墨,s)=C(金刚石,s) △H>0知,反应吸热,反应物石墨能量低,物质能量越低越稳定,则稳定性: 石墨>金刚石,故答案为:>;
(3)①增大反应物浓度,根据平衡移动原理分析,平衡向正反应方向移动,故答案为:正反应;
②该反应为吸热反应,升高温度平衡向正反应方向移动,K增大,故答案为:增大;
③Qc=![]() <0.263,则未达到平衡,故答案为:未达到;
<0.263,则未达到平衡,故答案为:未达到;
(4)①右侧为原电池的正极,电极反应为Ag++e-=Ag,则X溶液为AgNO3,故答案为:AgNO3;
②图二装置为电解池,在铁件上镀铜,铁作阴极,则铜作阳极,失去电子,发生氧化反应,电极反应是Cu-2e-=Cu2+,故答案为:Cu-2e-=Cu2+。


科目:高中化学 来源: 题型:
【题目】海水电池是我国1991年研制的以铝—空气—海水为能源的新型电池,可用于航海标志灯的供电。
(1)下列装置的模型,能体现海水电池工作原理的是_______(填字母)。
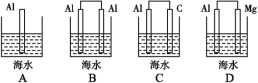
(2)海水电池工作过程中,负极的电极反应式为____,该极是电子___(填“流出”或“流入”)的一极,发生___反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是制备重铬酸钾的实验装置示意图:
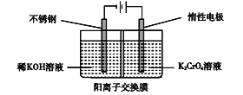
下列说法不正确的是
A.在阴极室,发生的电极反应为: 2H2O+2e- = 2OH -+ H2↑
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O向右移动
Cr2O72-(橙色)+H2O向右移动
C.该制备过程总反应为: 4K2CrO4 + 4H2O![]() 2K2Cr2O7 + 4KOH + 2H2↑+ O2↑
2K2Cr2O7 + 4KOH + 2H2↑+ O2↑
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比(nK/nCr)为d,则此时铬酸钾的转化率为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)水溶液中的离子平衡是中学化学中重要知识。
①常温下,0.001mol/LNaOH溶液的pH=____;
②(NH4)2SO4是一种重要的氮肥,长期施用会使土壤酸化,其原因是_______(用离子方程式表示);
③已知在25℃:AgCl(s) ![]() Ag+(aq)+Cl-(aq) Ksp=1.8×10-10,Ag2S(s)
Ag+(aq)+Cl-(aq) Ksp=1.8×10-10,Ag2S(s) ![]() 2Ag+(aq)+S2-(aq) Ksp=6.3×10-50,向KCl和K2S浓度均为0.001mol/L的混合溶液中,逐滴加入AgNO3溶液,最先产生的沉淀是_____(填“AgCl”或“Ag2S”)。
2Ag+(aq)+S2-(aq) Ksp=6.3×10-50,向KCl和K2S浓度均为0.001mol/L的混合溶液中,逐滴加入AgNO3溶液,最先产生的沉淀是_____(填“AgCl”或“Ag2S”)。
(2)甲醇是可再生能源,其燃烧热为726.5kJ·mol-1。下列能正确表示甲醇燃烧的热化学方程式的是____(填字母代号)。
A.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=+726.5kJ·mol-1
O2(g)=CO2(g)+2H2O(l) △H=+726.5kJ·mol-1
B.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=726.5kJ·mol-1
O2(g)=CO2(g)+2H2O(l) △H=726.5kJ·mol-1
C.CH3OH+![]() O2=CO2+2H2O △H=726.5kJ·mol-1
O2=CO2+2H2O △H=726.5kJ·mol-1
(3)800℃,向某恒容密闭容器中充入反应物A,发生反应2A(g) ![]() 2B(g)+C(g) △H<0。已知A的浓度随时间的变化如下:
2B(g)+C(g) △H<0。已知A的浓度随时间的变化如下:
反应时间((min) | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
c(A)(mol/L) | 1.0 | 0.80 | 0.67 | 0.58 | 0.43 | 0.50 | 0.50 |
请回答下列问题:
①在10-20min内,A的平均反应速率为________mol/(L.min);
②不能说明该反应达到化学平衡状态的是__________(填字母代号);
A.容器内气体密度不再变化 B.容器内气体平均摩尔质量不再变化 C.容器内气体的压强不再变化
③800℃时,平衡常数K=_________;
④若温度将为600℃,其平衡常数K将________(填“增大”、“减小”、或“不变”)。
(4)如图所示,闭合S后不久,可观察到滤纸a端附近呈蓝色,则:
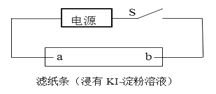
①滤纸b端与电源__________(填“正极”或“负 极”)相连;
②滤纸a端发生的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以0.10mol/L的氢氧化钠溶液滴定同浓度某一元酸HA的滴定曲线如图所示(![]() )。下列表述错误的是( )
)。下列表述错误的是( )
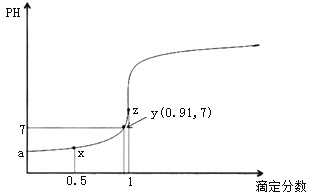
A.z点后存在某点,溶液中的水的电离程度和y点的相同
B.a约为3.5
C.z点处,![]()
D.x点处的溶液中离子满足:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.铝的第一电离能比镁的第一电离能大
B.同一主族元素从上到下电负性逐渐变大
C.镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态
D.最外层电子数是核外电子总数![]() 的原子和最外层电子排布式为4s24p5的原子是同种元素原子
的原子和最外层电子排布式为4s24p5的原子是同种元素原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知溶解度也可用物质的量浓度表示,25℃时,Ag2CrO4在不同浓度CrO42-溶液中的溶解度如图所示。又知Ksp(AgCl)=1.8×10-10。下列说法正确的是
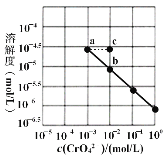
A.图中a、b两点c(Ag+)相同
B.该温度下,Ag2CrO4溶度积的数量级为10-12
C.加热蒸发饱和Ag2CrO4溶液再恢复到25℃,可使溶液由a点变到b点
D.将0.01 mol/L AgNO3溶液滴入20mL0.01 mol/L KCl和0.01 mol/L K2CrO4的混合溶液中,CrO42-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】VCB是锂离子电池的一-种添加剂,以环氧乙烷(EO)为原料制备VCB的一种合成路线如下:
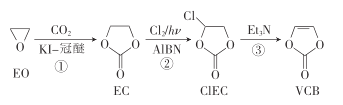
下列说法错误的是
A.反应①的原子利用率为100%
B.②的反应类型为取代反应.
C.EO、EC的一氯代物种数相同
D.CIEC、VCB分子中所有原子均处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于具有超低耗电量、寿命长的特点,LED产品越来越受人欢迎。如图是氢氧燃料电池驱动LED发光的装置。
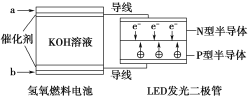
①a处通入的气体是氢气,b处通入的气体是氧气;
②该装置中只涉及两种形式的能量变化;
③电池正极的电极反应式为O2+2H2O+4e-=4OH-;
④P型半导体连接的是电池负极。上述说法中正确的是( )
A.①②B.①③C.③④D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com