
【题目】科学家最近在-100 ℃的低温下合成一种烃X,此分子的模型如下图(图中的连线表示化学键),下列说法正确的是( )
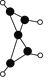
A. X能使溴的四氯化碳溶液褪色
B. X是一种在常温下能稳定存在的液态烃
C. X分子中在同一平面上的碳原子最多有5个
D. 充分燃烧等质量的X和甲烷,X消耗氧气多
科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活中的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
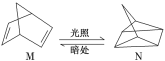
ΔH=+88.6 kJ/mol则M、N相比,较稳定的是_____________。
(2)已知CH3OH(l)的燃烧热ΔH=-238.6 kJ/mol,CH3OH(l)+12O2(g)=CO2(g)+2H2(g) ΔH=-a kJ/mol,则a________238.6(填“>”“<”或“=”)。
(3)将Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:__________________________________。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1 176 kJ/mol,则反应过程中,每转移1 mol电子放出的热量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铱(Ir)和锇(Os)属于铂族金属,与金、银合称贵重金属,可以用于电气、精密仪表、催化剂等领域。铱锇矿的主要成分有Ir、Os、Ir2O3、OsO2,还含有CuO和SiO2等杂质,从铱锇矿中提取铱(Ir)和锇(Os)的流程如下:
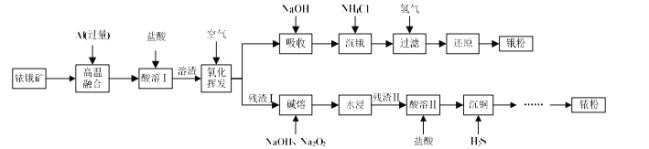
已知:①高温融合发生反应的原理类似于铝热反应。
②四氧化锇(OsO4)的熔点为41℃,易挥发、有恶臭和剧毒。
③四氨合二氧氯化锇([OsO2(NH3)4]Cl2)呈浅黄色,难溶于有机物,微溶于水,能水解。
回答下列问题:
(1)“酸溶I”的目的是_____________________________________;酸溶I后溶渣的主要成分除Ir、Os外,还有_______ (填化学式)。
(2)“氧化挥发”是将溶渣置于300~800 ℃的管式炉内,通入空气氧化。用NaOH溶液吸收OsO4生成Na2OsO4,该反应的离子方程式为 __________________;当吸收液质量增加59.5 g时,反应转移电子的数目为 ______。
(3)“沉锇”时, NH4Cl与Na2OsO4发生反应Na2OsO4 + 4NH4Cl=[OsO2(NH3)4]Cl2↓ + 2NaCl + 2H2O,该过程中NH4Cl需过量,目的是_____________________________ ;生成的锇盐要立即过滤,滤饼要经无水乙醇多次洗涤,用无水乙醇洗涤的原因是____。
(4)“残渣I”的主要成分为Ir、CuO和SiO2。“碱熔”时,Ir与Na2O2反应生成IrO2·nNa2O和O2,该反应的化学方程式为 _______________________。
(5) “沉铜” 过程中,当通入H2S 达到饱和时测得溶液的pH=1,此时溶液中c(Cu2+)为____。[已知:25 ℃下,H2S溶于水形成饱和溶液时,c(H2S)=0.1mol/L;H2S的电离常数![]() ,
,![]() ;
;![]() ]
]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸厄洛替尼是一种治疗肺癌的药物,以芳香化合物A为原料,制备其中间体H的合成路线如下:
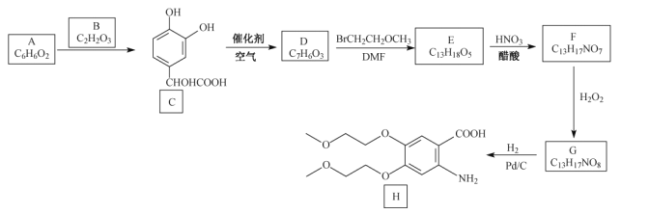
已知:B、D、E、F均能发生银镜反应。
回答下列问题:
(1)A的化学名称__________________。
(2)由A生成C的反应类型为__________________。
(3)B、G的结构简式依次为__________________、__________________。
(4)D生成E的化学方程式为______________________________________________________。
(5)H中含氧官能团名称为_________________。
(6)芳香化合物X是C的同分异构体,写出满足如下条件的X的结构简式:_______________。
①能发生水解反应;②能发生银镜反应;③核磁共振氢谱有四组峰,峰面积之比为3:2:2:1
(7)2-氨基苯乙醚(![]() )可用作染料、香料、医药中间体。请设计以苯酚和乙醇为起始原料制备2-氨基苯乙醚的合成路线____________________________(无机试剂任选)。
)可用作染料、香料、医药中间体。请设计以苯酚和乙醇为起始原料制备2-氨基苯乙醚的合成路线____________________________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,NO跟![]() 可以发生反应:
可以发生反应:![]() ,关于该反应下列说法中不正确的是()
,关于该反应下列说法中不正确的是()
A.![]() 既不是氧化产物也不是还原产物
既不是氧化产物也不是还原产物
B.该反应中被氧化和被还原的氮元素的质量比是2:3
C.若有![]() 完全反应,共转移12mol电子
完全反应,共转移12mol电子
D.NO是氧化剂,![]() 是还原剂
是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用分类法研究化学物质可系统、全面认识物质的性质。
I下列三组物质中,均有一种物质的类别与其他三种不同。
①MgO、![]() 、
、![]() 、CuO
、CuO
②HCl、![]() 、
、![]() 、
、![]()
③NaOH、![]() 、KOH、
、KOH、![]()
(1)三种物质依次是![]() 填化学式
填化学式![]() :
:
①______;②______;③______。
(2)这三种物质相互作用可生成一种新物质![]() ,该反应______
,该反应______![]() 填“是”或“不是”
填“是”或“不是”![]() 氧化还原反应。
氧化还原反应。
(3)写出![]() 与足量稀硫酸反应的离子方程式:______。
与足量稀硫酸反应的离子方程式:______。
(4)![]() 与
与![]() 、
、![]() 在溶液都不能大量共存,试用离子方程式说明:____________________________;________________________________________________
在溶液都不能大量共存,试用离子方程式说明:____________________________;________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)CO 还原 NO 的反应为 2CO(g)+ 2NO(g)2CO2 (g)+ N2 (g) H= -746kJmol-1。部分化学键的键能数据如下表(CO 以 C≡O 键构成):
化学键 | C≡O | N≡N | C=O |
E/(kJ·mol-1) | 1076 | 945 | 745 |
① 由以上数据可求得 NO 的键能为________________kJ·mol-1。
② 写出两条有利于提高 NO 平衡转化率的措施______________。
(2)一定条件下,向某恒容密闭容器中充入 x mol CO2 和 y mol H2,发生的反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH= 50 kJmol1。
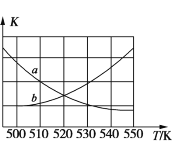
①图中能表示该反应的平衡常数 K 与温度 T 之间的变化关系曲线为____________ (填“a”或“b”),其判断依据是________ 。
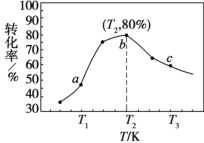
②若 x=2、y=3,测得在相同时间内不同温度下 H2 的转化率如图所示,则在该时间段内, 恰好达到化学平衡时,此时容器内的压强与反应开始时的压强之比为________。
(3)在有氧条件下,新型催化剂 M 能催化 NH3 与 NOx 反应生成 N2。
① NH3 与 NO2 生成 N2 的反应中,当生成 28g N2 时,转移的电子数为_______________mol(结果保留三位有效数字)。
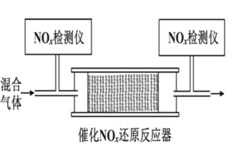
② 将一定比例的 O2、NH3 和 NOx 的混合气体,匀速通入装有催化剂 M 的反应器中反应(装置如图)。
反应相同时间 NOx 的去除率随反应温度的变化曲线如图所示:
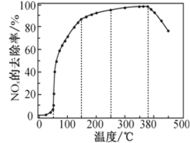
在 50~250 ℃范围内随着温度的升高,NOx 的去除率先迅速上升后上升缓慢的主要原因是_______________;当反应温度高于 380 ℃时,NOx 的去除率迅速下降的原因可能是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用FeCl3溶液蚀刻铜箔回收铜的一种流程如图所示。下列叙述正确的是
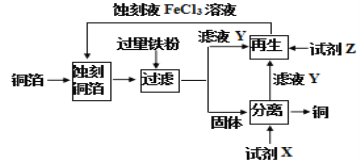
A.蚀刻铜箔的离子方程式:2Cu+Fe3+→2Cu2++Fe2+B.试剂X是盐酸或稀硝酸
C.滤液Y呈浅绿色D.试剂Z只能是氯水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物a和苯反应生成有机物b。下列分析正确的是
![]() + HCl
+ HCl
A.该反应是加成反应
B.若R为CH3,b中所有原子可能共面
C.若R为CH3,b的一氯代物共有3种
D.若R为C4H9,b可能的结构有4种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com