
| A、氧化产物与还原产物的物质的量之比为2:1 |
| B、铁粉剩余,溶液呈浅绿色,Cl-基本不变 |
| C、向溶液中滴入无色KSCN溶液,仍无色 |
| D、Fe2+和Fe3+物质的量之比为1:1 |
| 0.56g |
| 56g/mol |
| 0.56g |
| 56g/mol |


 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
| A、2 mol?L-1 |
| B、1 mol?L-1 |
| C、0.5 mol?L-1 |
| D、0.25 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Al3+、Cl-、SO42- |
| B、Na+、HCO3-、Cl-、OH-, |
| C、Ca2+、Na+、CO32-、NO3- |
| D、H+、Fe2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1kg铜所含原子的数目为dNA | ||
B、一个铜原子所占有的体积为(
| ||
C、一个铜原子的质量为
| ||
D、1dm3铜所含有的原子数为
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将盐卤或石膏加入豆浆中制成豆腐 |
| B、一枝钢笔使用两种不同型号的蓝黑墨水,易出现堵塞 |
| C、向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀 |
| D、清晨,阳光穿过树林枝叶间的间隙形成“光柱” |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、H2O2的电子式: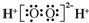 |
| B、原子核内含有77个质子、115个中子的铱(Ir)原子:11577Ir |
C、氯离子的结构示意图: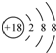 |
D、对二甲苯的结构简式: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| B、升高温度,c(OH-)与c(CH3COO-)的比值将减小 |
| C、CH3COONa稀溶液加水稀释时,溶液中各离子浓度均减小 |
| D、c(CH3COO-)+c(CH3COOH)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com