
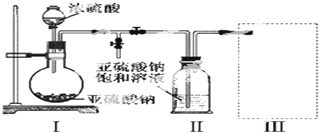
分析 (1)由装置Ⅱ中发生的反应可知,装置Ⅰ中产生的气体为SO2,亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫与水;
(2)装置Ⅱ中获得已析出的晶体,分离固体与液态,应采取过滤操作;
(3)装置Ⅲ用于处理尾气,吸收为反应的二氧化硫,应防止倒吸,且不能处于完全密闭环境中;
(4)Na2S2O5晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可;
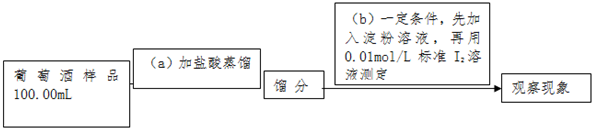
(5)①当滴入最后一滴I2溶液时,溶液从无色恰好变为蓝色,且30秒内不褪色;
二氧化硫具有还原性、碘具有氧化性,二者在水溶液中发生反应SO2+I2+2H2O═H2SO4+2HI;
②由消耗碘的量,结合SO2+I2+2H2O═H2SO4+2HI计算二氧化硫的质量,进而计算浓度;
③若有部分HI被空气氧化,则消耗碘的量偏小,故测定二氧化硫的量偏小.
解答 解:(1)由装置Ⅱ中发生的反应可知,装置Ⅰ中产生的气体为SO2,亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫与水,反应方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)装置Ⅱ中获得已析出的晶体,分离固体与液态,应采取过滤进行分离,
故答案为:过滤;
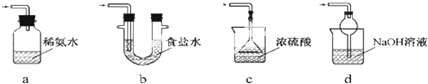
(3)a.装置应将导管深入氨水中可以吸收二氧化硫,但为密闭环境,装置内压强增大易产生安全事故,故错误;
b.该装置吸收二氧化硫能力较差,且为密闭环境,装置内压强增大易产生安全事故,故错误;
c.该装置不能吸收二氧化硫,所以无法实现实验目的,故错误;
d.该装置中氢氧化钠与二氧化硫反应,可以吸收,且防止倒吸,故正确;
故答案为:d;
(4)Na2S2O5中S元素的化合价为+4价,因此会被氧化为为+6价,即晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可,实验方案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成,
故答案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成;
(5)①当滴入最后一滴I2溶液时,溶液从无色恰好变为蓝色,且30秒内不褪色;二氧化硫具有还原性、碘具有氧化性,二者在水溶液中发生反应SO2+I2+2H2O═H2SO4+2HI,
上述实验方案,(b)步操作的原理是SO2+I2+2H2O═H2SO4+2HI,操作后应观察的现象是滴入最后一滴I2溶液时,溶液从无色恰好变为蓝色,且30秒内不褪色,
故答案为:SO2+I2+2H2O═H2SO4+2HI;滴入最后一滴I2溶液时,溶液从无色恰好变为蓝色,且30秒内不褪色;
②令100mL葡萄酒中二氧化硫的质量为mg,则:
SO2+2H2O+I2═H2SO4+2HI
64g 1mol
mg 0.025L×0.01mol/L
所以,64g:mg=1mol:0.025L×0.01mol/L,
解得m=0.016
故该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为$\frac{0.016g}{0.1L}$=0.16 g/L
故答案为:0.16;
③若有部分HI被空气氧化,则消耗碘的量偏小,故测定二氧化硫的量偏小,则测定结果偏低,
故答案为:偏低.
点评 本题考查物质的制备实验、实验方案设计、物质含量的测定、氧化还原反应滴定等,题目难度中等,明确实验原理是解本题关键,根据物质的性质分析解答,注意元素化合物知识的积累和灵活运用.


科目:高中化学 来源: 题型:实验题

| SO2的转化率% | 0.1MPa | 1MPa | 10MPa |
| 400°C | 99.2 | 99.7 | 99.9 |
| 600°C | 73.7 | 89.5 | 96.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.5 mol•L-1•s-1 | B. | v(B)=0.5 mol•L-1•s-1 | ||
| C. | v(C)=1.8 mol•L-1•min-1 | D. | v(D)=1 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热、冷却、称量,重复两次即是恒重操作 | |
| B. | 瓷坩埚加热后冷却时,必须放在干燥器中 | |
| C. | 加热晶体时先用小火,后渐改为用大火加热 | |
| D. | 加热时如晶体爆溅出坩埚,应再加一些晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| B. | 高锰酸钾溶液、酒精、过氧化钠都能杀菌消毒,消毒原理相同,都利用了强氧化性 | |
| C. | “加碘食盐”、“含氟牙膏”、“富硒营养品”、“高钙牛奶”、“加铁酱油”等等,这里的碘、氟、硒指的是对应的单质分子,而钙、铁则指的是对应的钙离子和铁离子 | |
| D. | PM2.5是指大气中直径接近2.5微米的颗粒物,入肺影响健康,这种颗粒物分散空气中形成胶体,它具有丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某学习小组在实验室里用乙醇与浓硫酸混合加热制乙烯,并进行有关乙烯性质的探究.装置如图.请帮助回答下列问题:
某学习小组在实验室里用乙醇与浓硫酸混合加热制乙烯,并进行有关乙烯性质的探究.装置如图.请帮助回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x+y<z | B. | 平衡正向移动 | C. | A的转化率降低 | D. | C的物质的量增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com