
要除去![]() 中含有的少量
中含有的少量![]() 杂质,可以从:①NaOH溶液 ②饱和
杂质,可以从:①NaOH溶液 ②饱和![]() 溶液 ③
溶液 ③![]() 溶液 ④硝酸酸化的
溶液 ④硝酸酸化的![]() 溶液 ⑤氨水 ⑥酸性
溶液 ⑤氨水 ⑥酸性![]() 溶液中,选用的试剂是
溶液中,选用的试剂是
[ ]
科目:高中化学 来源: 题型:
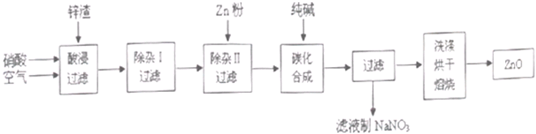
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 | 8.0 |
查看答案和解析>>
科目:高中化学 来源:高一化学(通用各科奥林匹克ABC卷及解析) 题型:043
要除去下列物质中的杂质,把除杂的试剂或方法填写在横线上:
(1)![]() 中含有少量的
中含有少量的![]()
________________________________________________________
(2)食盐中混有少量的![]()
________________________________________________________
(3)苛性钠中混有少量纯碱
________________________________________________________
(4)过氧化钠中混有少量的氧化钠
________________________________________________________
查看答案和解析>>
科目:高中化学 来源:广东省2009届高三化学各地名校月考试题汇编-铁铜及其化合物(1) 题型:058
某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾.其设计的实验过程为:

(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于________上,取用坩埚应使用________,灼烧后的坩埚应放在________上,不能直接放在桌面上.(填入以下所给仪器的编号)
实验所用仪器:
a、蒸发皿 b、石棉网 c、泥三角 d、表面皿 e、坩埚钳 f、试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾.灼烧后含有少量铜的可能原因是________
a、灼烧过程中部分氧化铜被还原
b、灼烧不充分铜未被完全氧化
c、氧化铜在加热过程中分解生成铜
d、该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、________、冷却结晶、________、自然干燥
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是:________、________;
(5)测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验中,称量操作至少要进行________次;
(6)若测定结果x值偏高,可能的原因是________
a、加热温度过高
b、胆矾晶体的颗粒较大
c、加热后放在空气中冷却
d、胆矾晶体部分风化
查看答案和解析>>
科目:高中化学 来源:广东省2009届高三化学各地名校月考试题汇编-实验探究(1) 题型:058
某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾.其设计的实验过程为:

(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于________上,取用坩埚应使用________,灼烧后的坩埚应放在________上,不能直接放在桌面上.(填入以下所给仪器的编号)
实验所用仪器:
a、蒸发皿 b、石棉网 c、泥三角 d、表面皿 e、坩埚钳 f、试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾.灼烧后含有少量铜的可能原因是________
a、灼烧过程中部分氧化铜被还原
b、灼烧不充分铜未被完全氧化
c、氧化铜在加热过程中分解生成铜
d、该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、________、冷却结晶、________、自然干燥
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是:________、________;
(5)测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验中,称量操作至少要进行________次;
(6)若测定结果x值偏高,可能的原因是________
a、加热温度过高
b、胆矾晶体的颗粒较大
c、加热后放在空气中冷却
d、胆矾晶体部分风化
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+、Cu2+等杂质)生产医药级二水合氯化钙(CaCl2?2H2O的质量分数为97.0%~103.0%)的主要流程如下:
![]()
![]()
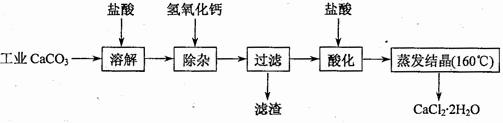
![]() (1)除杂操作是加入氢氧化钙,调节溶液的pH,以除去溶液中的少量Al3+、Fe3+、Cu2+。
(1)除杂操作是加入氢氧化钙,调节溶液的pH,以除去溶液中的少量Al3+、Fe3+、Cu2+。
①已知Cu(OH)2的KSP=2×l0-20 (mol/L)3。要使0. 2mol?L-1CuCl2溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一,此时Al3+、Fe3+已沉淀完全),则应向溶液里加入强碱溶液至溶液的pH为______。
②检验Fe(OH)3已经沉淀完全的实验操作是 ;
③如果将氢氧化钙改为纯净的碳酸钙,请用离子方程式表达除去溶液中Fe3+的过程:
。
![]() (2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其主要目的是: 。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其主要目的是: 。
![]() (3)测定样品中Cl-含量的方法是:a.称取0.75g样品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用0.05mol?L-1AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39mL。
(3)测定样品中Cl-含量的方法是:a.称取0.75g样品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用0.05mol?L-1AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39mL。
![]() ①上述测定过程中需要溶液润洗的仪器有 。
①上述测定过程中需要溶液润洗的仪器有 。
![]() ②量取25.00mL待测溶液于锥形瓶中时,如果开始滴定管的液面读数为5.10mL,左手控制滴定管的活塞,使待测溶液流入锥形瓶中,眼睛注视着 ,直到 ,迅速关闭活塞。
②量取25.00mL待测溶液于锥形瓶中时,如果开始滴定管的液面读数为5.10mL,左手控制滴定管的活塞,使待测溶液流入锥形瓶中,眼睛注视着 ,直到 ,迅速关闭活塞。
③计算上述所得样品中CaCl2?2H2O的质量分数为 。
![]() ④若用上述办法测定的样品中CaCl2?2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有 ; 。
④若用上述办法测定的样品中CaCl2?2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有 ; 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com