
| A. | SO2具有漂白性,因而可以使石蕊试液褪色 | |
| B. | 大气中SO2的主要来源是汽车排出的尾气 | |
| C. | SO2是硫酸的酸酐 | |
| D. | SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物 |
分析 A.二氧化硫不能漂白指示剂;
B.汽车尾气中主要含氮的氧化物;
C.二氧化硫中硫为+4价,与水反应生成亚硫酸;
D.依据二氧化硫中硫为+4价,可以由+6价硫降价得到或者由0或者-2价硫升价得到.
解答 解:A.二氧化硫为酸性氧化性,能够使石蕊变红,虽然具有漂白性,但是二氧化硫不能使石蕊褪色,故A错误;
B.二氧化硫主要来源含硫物质的燃烧,汽车尾气中主要含氮的氧化物,故B错误;
C.SO2与水反应生成亚硫酸,硫酸的酸酐为SO3,故C错误;
D.S、H2S氧化可生成SO2,浓硫酸被还原也可生成SO2,故D正确;
故选:D.
点评 本题考查二氧化硫的性质,熟悉二氧化硫具有氧化性、还原性和漂白性是解题关键,注意二氧化硫不能漂白指示剂,题目难度不大.


 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:解答题
 已知N2和H2在一定条件下发生下列可逆反应:
已知N2和H2在一定条件下发生下列可逆反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
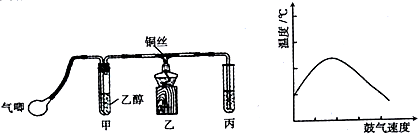
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①④⑤⑥ | C. | ①②③④⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
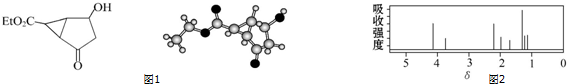
| A. | 该有机物不同化学环境的氢原子有6种 | |
| B. | 该有机物属于芳香化合物 | |
| C. | 键线式中的Et代表的基团为-CH3 | |
| D. | 该有机物在一定条件下能与金属钠、乙酸发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
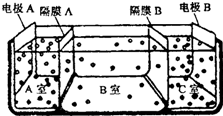
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com