
| 选项 | 参数 | 比较 | 解释 |
| A | 沸点 | HF<HCl<HI | 组成结构相似的物质,相对分子质量越大沸点越高 |
| B | 半径 | Na+>Al3+>S2- | 同一周期粒子半径随原子序数的递增逐渐减小 |
| C | 酸性 | H2SO3>H2CO3 | 元素的非金属性越强,其含氧酸的酸性越强 |
| D | 还原性 | P3->S2->Cl- | 元素的非金属性越强,简单阴离子的还原性越弱 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氢化物都属于分子晶体,分子晶体的熔沸点与相对分子质量成正比,但含有氢键的熔沸点较高;
B.电子层越多半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
D.元素的非金属性越强,其简单阴离子的还原性越弱.
解答 解:A.氢化物都属于分子晶体,分子晶体的熔沸点与相对分子质量成正比,但含有氢键的熔沸点较高,这几种氢化物中HF中含有氢键,熔沸点最高,所以熔沸点高低为HCl<HI<HF,故A错误;
B.电子层越多半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,所以离子半径S2->Na+>Al3+,故B错误;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,亚硫酸不是S元素的最高价氧化物的水化物,所以不能根据酸性强弱判断非金属性强弱,故C错误;
D.元素的非金属性越强,其简单阴离子的还原性越弱,非金属性Cl>S>P,所以离子的还原性P3->S2->Cl-,故D正确;
故选D.
点评 本题考查氢化物熔沸点高低判断、离子半径半径、非金属性强弱与酸及简单阴离子还原性的关系,侧重考查学生分析判断能力,明确元素周期律及物质性质即可解答,注意A中氢键对物质熔沸点的影响,题目难度不大.


科目:高中化学 来源: 题型:解答题
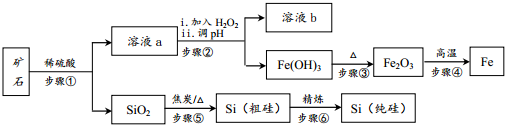
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改变反应条件使平衡向正反应方向移动,反应物的转化率一定增大 | |
| B. | 浓度变化引起平衡向正反应方向移动,反应物的转化率一定增大 | |
| C. | 温度或压强的变化引起平衡向正反应方向移动,反应物的转化率一定增大 | |
| D. | 催化剂可使化学反应速率加快,使反应物的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠原子失电子能力比镁弱 | B. | 水比硫化氢稳定 | ||
| C. | 硅酸比磷酸酸性强 | D. | 氢氧化钙比氢氧化锶碱性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A和B的转化率均是20% | B. | x=4 | ||
| C. | 平衡时A的物质的量为3.2mol | D. | 平衡时气体压强比原来减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
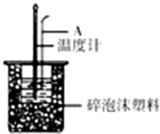 分别取40mL的0.50mol/L盐酸与40mL0.55mol/L氢氧化钠溶液进行中和热的测定.下列说法错误的是( )
分别取40mL的0.50mol/L盐酸与40mL0.55mol/L氢氧化钠溶液进行中和热的测定.下列说法错误的是( )| A. | 稍过量的氢氧化钠是确保盐酸完全反应 | |
| B. | 仪器A的名称是环形玻璃搅拌棒 | |
| C. | 在实验过程中,把温度计上的酸用水冲洗干净后再测量NaOH溶液的温度 | |
| D. | 用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,结果也是正确的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m值为3 | |
| B. | B的转化率为20% | |
| C. | A的平均反应速率为0.1mol•L-1•min-1 | |
| D. | 平衡时反应混合物总物质的量为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO3、H2SO4、H2SO3 | B. | SO2、H2SO3、H2SO4 | C. | SO3、H2SO3、H2SO4 | D. | SO2、H2SO4、H2SO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com