
【题目】2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上冶炼钼的化学原理为①2MoS2+7O2![]() 2MoO3+4SO2;②MoO3+2NH3·H2O====(NH4)2MoO4+H2O;③(NH4)2MoO4+2HCl====H2MoO4↓+2NH4Cl;④H2MoO4
2MoO3+4SO2;②MoO3+2NH3·H2O====(NH4)2MoO4+H2O;③(NH4)2MoO4+2HCl====H2MoO4↓+2NH4Cl;④H2MoO4![]() MoO3+H2O;⑤用还原剂将MoO3还原成金属钼。
MoO3+H2O;⑤用还原剂将MoO3还原成金属钼。
则下列说法正确的是
A. MoS2煅烧产生的尾气可直接排空
B. MoO3是金属氧化物,也是碱性氧化物
C. H2MoO4是一种强酸
D. 利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为3∶3∶2
科目:高中化学 来源: 题型:
【题目】四种短周期元素的性质或结构信息如下表,请根据信息回答下列问题。
元素 | T | X | Y | Z |
性质结构信息 | 人体内含量最多的元素,且其单质是常见的助燃剂。 | 单质为空气中含量最多的气体,该气体为双原子分子,分子中含有3对共用电子对。 | 单质质软、银白色固体、导电性强。单质在空气中燃烧发出黄色的火焰。 | 第三周期的金属元素,其氧化物有两性。 |
(1)元素T的离子结构示意图_____;元素X的气态氢化物的电子式____;Y的最高价氧化物的水化物属于____化合物(填“离子”或“共价”)。
(2)Z的最高价氧化物对应水化物的电离方程式_________。
(3)元素Z与镁元素相比,金属性较强的是___(用元素符号表示),下列表述中不能证明这一事实的是_____。
a.氢氧化镁不溶于氢氧化钠,而氢氧化铝可溶于氢氧化钠
b.镁能置换出熔融氧化铝中的铝
c.镁能跟二氧化碳反应,而铝不能
d.等量的镁铝和足量的盐酸反应时,铝失电子的数目比镁多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,定容密闭容器中0.4mol/LN2,1mol/LH2进行反应:N2(g)+ 3H2(g)![]() 2NH3(g),10min反应达到平衡,此时测得N2浓度为0.2mol/L。
2NH3(g),10min反应达到平衡,此时测得N2浓度为0.2mol/L。
(1)10min内,用H2浓度变化来表示的反应速率为___,平衡时NH3的物质的量浓度为____;
(2)能判断该反应达到化学平衡状态的依据是____
A.容器中密度不随时间变化而变化 B.容器中各物质的浓度保持不变
C.N2和NH3的消耗速率之比为2∶1 D.N2消耗速率与H2生成速率之比为3:1
(3)平衡时N2和H2的转化率之比为____;该反应的平衡常数表达式为K=____,该温度下反应的平衡常数是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3=2FeO![]() +3Cl+4H++H2O
+3Cl+4H++H2O
B.NaHCO3溶液中加少量Ba(OH)2溶液:HCO![]() +Ba2++OH-=BaCO3↓+H2O
+Ba2++OH-=BaCO3↓+H2O
C.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
D.用稀硫酸除去硫酸钠溶液中少量的硫代硫酸钠:S2O![]() +2H+=SO2↑+S↓+H2O
+2H+=SO2↑+S↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器中,能表示反应X(g)+2Y(g) ![]() 2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比是1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A. ①②B. ①④C. ②③D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成份是Al2O3,还含有Fe2O3、SiO2)提取氧化铝冶炼铝的原料(纯净的Al2O3),提取操作过程如下:

请回答下列问题:
(1)请写主要成份的化学式:滤渣A________,滤液丙中的溶质是NaCl和________。
(2)反应②中Al3+反应的离子方程式为_________________;反应③的离子方程式为____________;反应④的化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试液中只可能含有K+、NH![]() 、Fe2+、Al3+、Cl-、SO
、Fe2+、Al3+、Cl-、SO![]() 、CO
、CO![]() 、AlO
、AlO![]() 中的若干种离子,离子浓度均为0.1mol·L1,某同学进行了如下实验,下列说法正确的是( )
中的若干种离子,离子浓度均为0.1mol·L1,某同学进行了如下实验,下列说法正确的是( )

A.无法确定原试液中是否含有Al3+、Cl-
B.原溶液中存在NH![]() 、Fe2+、Cl-、SO
、Fe2+、Cl-、SO![]()
C.无法确定沉淀C的成分
D.滤液X中大量存在的阳离子有NH![]() 、Fe2+和Ba2+
、Fe2+和Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置探究Cl2和NO2在NaOH溶液中的反应,若通入适当比例的Cl2和NO2,即发生反应Cl2+2NO2+4NaOH=2NaNO3+2NaCl+2H2O。

下列叙述正确的是
A. 实验室中用二氧化锰与3 mol·L-1的盐酸共热制备氯气
B. 装置Ⅰ中盛放的试剂是浓硫酸,作用是干燥氯气
C. 装置Ⅲ的作用是便于控制通入NO2的量
D. 若制备的NO2中含有NO,应将混合气体通入水中以除去NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种重要的有机化工合成中间体F和Y可用甲苯为主要原料采用以下路线制得:
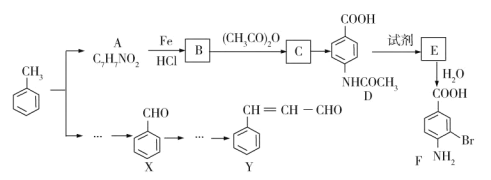
已知:
①![]()
![]()
![]()
②2CH3CHO![]() CH3CH(OH)CH2CHO
CH3CH(OH)CH2CHO![]() CH3CH=CHCHO
CH3CH=CHCHO
请回答下列问题:
(1)写出A的结构简式___________。
(2)B→C的化学方程式是________。
(3)C→D的反应类型为__________。
(4)1molF最多可以和________molNaOH反应。
(5)在合成F的过程中,设计B→C步骤的目的是_________。
(6)写出符合下列条件的3种A的同分异构体的结构简式_________、______、_______。
①苯环上只有两种不同化学环境的氢原子
②能发生银镜反应
(7)以X和乙醇为原料通过3步可合成Y,请设计合成路线______(无机试剂及溶剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com