
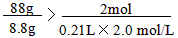


科目:高中化学 来源:物理教研室 题型:038
(1)收集到的H2S气体的体积(标准状况);
(2)溶液中Fe2+和H+的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:038
已知FeS+2HCl══FeCl2+H2S↑,将8.8gFeS固体置于200mL2.0mol×L-1的盐酸中,以制备H2S气体,反应完全后,若溶液中H2S的浓度为0.10mol×L-1,假定溶液体积不变,试计算:
(1)收集到的H2S气体的体积(标准状况);
(2)溶液中Fe2+和H+的物质的量浓度。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com