
����Ŀ����ˮ���̲��ŷḻ����Դ����ˮ�ۺ����õ�ʾ��ͼ���£�����˵����ȷ����(����)

��ͨ���ȼҵ�������IJ�Ʒ��NaOH��NaClO�������
�ڳ�ȥ�����е�SO42-��Ca2����Mg2�������ʣ������Լ�����ز���˳������ǣ�NaOH��Һ��BaCl2��Һ��Na2CO3��Һ������������
�ۿɽ�MgCl2��6H2O�����ڿ�����ֱ�Ӽ�����ˮ�õ��ϴ�������ˮMgCl2
�ܵ��MgCl2��Һ����ȡ����þ
A.�٢�B.�ڢ�C.�ۢ�D.�٢�
���𰸡�D
��������
��ͨ���ȼҵ�����������������������ƣ��������IJ�Ʒ��NaOH��NaClO������ȣ�������ȷ������ȥ�����е�SO42����Ca2����Mg2�������ʣ������Լ�����ز���˳������ǣ�NaOH��Һ����þ���ӣ�BaCl2��Һ�����������Na2CO3��Һ���������ӺͶ���ı����ӣ����ˣ���Һ�к���̼���ơ������������ʣ����������̼���ơ��������ƣ�������ȷ�����ɽ�MgCl2��6H2O������HCl�����м�����ˮ�õ��ϴ�������ˮMgCl2�������������������MgCl2����ȡ����þ��������������٢���ȷ����D��ȷ��
������������ΪD��


 �������Ӳ�ϵ�д�
�������Ӳ�ϵ�д� ���ɿ��õ�Ԫ����AB��ϵ�д�
���ɿ��õ�Ԫ����AB��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������G��һ�ֿ���������������ҩ�ʵ�����ɷ�����A�Ʊ�G�ĺϳ�·�����£�
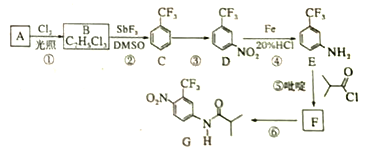
�ش��������⣺
��1��A�Ľṹ��ʽΪ_______________��C�Ļ�ѧ������________________________��
��2�����ķ�Ӧ�Լ��ͷ�Ӧ�����ֱ���______________________���÷�Ӧ��������___________��
��3�����ķ�Ӧ����ʽΪ_____________________________________________��
�����һ���л����������______________________________��
��4��G�ķ���ʽΪ______________________________��
��5��H��G��ͬ���칹�壬�䱽���ϵ�ȡ������G����ͬ��λ�ò�ͬ���������ܵĽṹ��_________�֡�
��6��4-����������������![]() ������Ҫ�ľ�ϸ�����м��壬д���ɱ����ѣ�
������Ҫ�ľ�ϸ�����м��壬д���ɱ����ѣ�![]() ���Ʊ�С���������ᱽ���ĺϳ�·�ߣ������Լ���ѡ��_______________��
���Ʊ�С���������ᱽ���ĺϳ�·�ߣ������Լ���ѡ��_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����н�������A��B��C��D������ס��ҡ���������E��F��G��H��I������֮���ܷ������·�Ӧ��ͼ����Щ��Ӧ�IJ���ͷ�Ӧ������û��ȫ���������
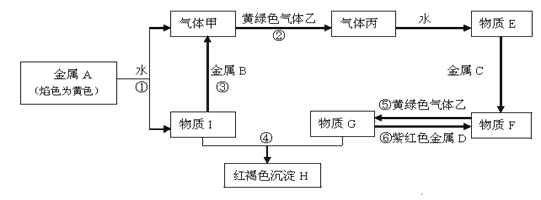
�����������Ϣ�ش��������⣺
��1��д���������ʵĻ�ѧʽ�� B____________�� F_____________��
��2����֪A��һ���������������DZͧ�Ĺ����������������﹩��ʱ�Ļ�ѧ����ʽΪ_____________
��3�����������ӷ���ʽ��________________��________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������м����л��A��CH4 B��(CH3)2C=CH��CH3 C��C2H2 D��C6H14 E��CH2=CH��CH=CH2 F��������
��1�������л����л�Ϊͬϵ�����______(����ţ���ͬ)����Ϊͬ���칹�����________��
��2����ϵͳ��������B��������________________��
��3��ʵ������ȡC�ķ�Ӧ�Ļ�ѧ����ʽΪ_________________��
��4����ͼ��ʾ����һ�ֽ���˫ϩ�ϳɵ��л���Ӧ����д�� B �� E����˫ϩ�ϳ����ò���Ľṹ��ʽ____��
![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���W������������߷��Ӳ��Ϻϳɵ��м���ȣ��Ʊ�W��һ�ֺϳ�·�����£�

��֪��![]() +CH3Cl
+CH3Cl![]()
![]() +HCl
+HCl
��ش��������⣺
(1)F��������_______���ķ�Ӧ������________��
(2)W�Ľṹ��ʽΪ_____________��
(3)��Ӧ�ڵĻ�ѧ����ʽ��____________��
(4)��Ӧ�۵Ļ�ѧ����ʽ��_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ǻϳ�����ҩ����������Ҫ�м��壬�Ա���Ϊԭ���Ʊ���������ĺϳ�·����ͼ��ʾ��
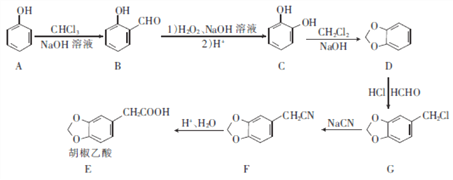
�ش��������⣺
��1�����й����л���B��˵����ȷ���� ____________(����ĸ����
a.����FeCl3��Һ������ɫ��Ӧ
b.�˴Ź���������ֻ��3���
c.�ܷ���������Ӧ
d.������ˮ�����ӳɷ�Ӧ
��2��C��������___________��C D�ķ�Ӧ������_______��
��3����������(E)�����������ŵ�����Ϊ __________ ��
��4��G����F�Ļ�ѧ����ʽΪ_____________��
��5��W��E��ͬ���칹�壬0.5 mol W������̼��������Һ��Ӧ����1 mol C02����֪W�ı�����ֻ��2��ȡ��������W�Ľṹ����__________(���������칹)�֣����к˴Ź��������������Ľṹ��ʽΪ_______��
��6�����������ϳ�·�ߣ�д����һ�ȼױ���![]() ��Ϊԭ�ϣ����Լ���ѡ���Ʊ�������ĺϳ�·�ߣ�____________________
��Ϊԭ�ϣ����Լ���ѡ���Ʊ�������ĺϳ�·�ߣ�____________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�����ͨѶ����ͨ���ճ����������Ź㷺��Ӧ�á�
(1)п�̸ɵ����Ӧ�����ձ�ĵ��֮һ����ͼΪп�̸ɵ�صĹ���ʾ��ͼ��п�̸ɵ�صĸ���������________(����������)�����������ĵ缫��ӦΪ_____________������Ӧ����32.5 g�������ϣ�������ת�Ƶ��ӵ���ĿΪ________��
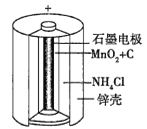
(2)Ŀǰ���õ�����(Ni-Cd)�ɳ���ص��ܷ�Ӧʽ�ɱ�ʾΪCd+2NiO(OH)![]() 2Ni(OH)2+Cd(OH)2����֪Ni(OH)2��Cd(OH)2��������ˮ�����������ᣬ����˵����ȷ����________(�����)��
2Ni(OH)2+Cd(OH)2����֪Ni(OH)2��Cd(OH)2��������ˮ�����������ᣬ����˵����ȷ����________(�����)��
�ٸõ�ؿ��������������½��г䡢�ŵ�
�ڸõ�طŵ�ʱ�������ĵ缫��ӦʽΪCd-2e-+2OH-=Cd(OH)2
�۸õ�طŵ�ʱ��Cd������������
�ܸõ�طŵ�ʱ����ѧ��ת��Ϊ����
(3)��ͼΪ����ȼ�ϵ�صĹ���ʾ��ͼ���������Һ��KOH��Һ����X��Ϊ��ص�________(����������������)����X���ĵ缫��ӦʽΪ_________��
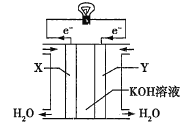
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������Ksp(AgCl)=1.8��10-10mol2/L2��Ksp(AgI)��1.0��10-16 mol2/L2������˵������ȷ����
A. ����ͬ�¶���AgCl���ܽ��С��AgI���ܽ��
B. AgCl��AgI��������ˮ�����AgCl��AgI�����ת��
C. �����£�AgC1��Ҫ��NaI��Һ�п�ʼת��ΪAgI����NaI��Ũ�ȱ��벻����![]() ��10-11mol/L
��10-11mol/L
D. ��������AgCl�ֱ��������������:��20mL0.01mol/LKCl��Һ ��10mL0.02mol/LCaCl2��Һ ��30mL0.05mol/LAgNO3��Һ��AgCl���ܽ���ɴ�С��˳��Ϊ�� ��>��>��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO��H2�ڹ�ҵ�ϳ���Ϊ��Ҫ�Ļ���ԭ�ϣ���������Ϊ�ϳ�������ҵ��CH4��H2O��������Ŀǰ���ģ��ȡ�ϳ�������Ҫ��������ԭ��Ϊ��
��Ӧ��CH4(g)+H2O(g)![]() CO(g)+3H2(g) H1=+210 kJ/mol
CO(g)+3H2(g) H1=+210 kJ/mol
��Ӧ��CO(g)+H2O(g)![]() CO2(g)+H2(g) H2=��41 kJ/mol
CO2(g)+H2(g) H2=��41 kJ/mol
(1)CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) H3=____ kJ/mol��
CO2(g)+4H2(g) H3=____ kJ/mol��
(2)��Ӧ��ﵽƽ��ı�־��_____��
A�����º�������£�ѹǿ���ٸı䡡��B��v��(CO)=3v��(H2)
C��ƽ����Է����������ٸı䡡������D�����º�������£������ܶȲ��ٸı�
(3)�������ݻ����䣬�����Ƿ�Ӧ�Է�Ӧ�����д�ʩ������COת���ʵ���____��
A�������¶ȡ�������������������������B����CO2����ϵ����
C������He��ʹ��ϵ��ѹǿ����������D����ԭͶ�ϱȼӱ�Ͷ��
(4)��1 mol CH4(g)��1 mol H2O(g)������º�ѹ���ܱ�������(�¶�298 K��ѹǿ100 kPa)��������Ӧ�����Ƿ�Ӧ��ķ������÷�Ӧ�У�����Ӧ����v��=k����p(CH4)��p(H2O)���淴Ӧ����v��=k����p(CO)��p3(H2)������k����k��Ϊ���ʳ�����pΪ��ѹ(��ѹ=��ѹ�����ʵ�������)����÷�Ӧ��ѹǿƽ�ⳣ��Kp=___(��k����k����ʾ)������������k��=4.4��104kPa-1��s-1����CH4�ֽ�20%ʱ��v��=__kPa��s-1��������λ��Ч���֣���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com