
【题目】根据下列五种元素的电离能数据(单位:kJ·mol-1),回答下列各题。

(1)在周期表中,最可能处于同一族的是________(填字母,下同)。
A.Q和R B.S和T C.T和U D.R和T E.R和U
(2)它们的氯化物的化学式,最可能正确的是________。
A.QCl2 B.RCl C.SCl3 D.TCl E.UCl4
(3)S元素最可能是________。
A.s区元素 B.稀有气体元素 C.p区元素 D.准金属 E.d区元素
(4)下列元素中,化学性质和物理性质最像Q元素的是________。
A.硼(1s22s22p1) B.铍(1s22s2) C.锂(1s22s1) D.氢(1s1) E.氦(1s2)
【答案】E B A E
【解析】
电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫第一电离能,气态基态正一价阳离子失去一个电子转化为气态基态正二价阳离子所需要的最低能量叫第二电离能……。元素的原子第一电离能越小,表示气态时越容易失去电子,即该元素在气态时的金属性越强。由此分析。
(1)由表中数据可知,R元素的第二电离能约为第一电离能的9.2倍,第三电离能约为第二电离能的1.5倍,第四电离能约为第三电离能的1.4倍,说明R原子最外层只有一个电子;同样,U元素的第二电离约为第一电离能的7.4倍,第三电离能约为第二电离能的1.4倍,第四电离能约为第三电离能的1.3倍,说明U原子最外层也只有一个电子;所以R和U最可能处于同一族,答案选E。
(2)A.分析Q元素的I1、I2、I3、I4可知,后一级电离能都约为前一级电离的1~2倍,差别不大,因此这4个电子很可能都在最外层上,所以其氯化物的化学式不可能是QCl2,A项错误; B.由(1)分析可知R原子最外层只有1个电子,且第一电离能很小,说明R易失去1个电子显+1价,所以其氯化物的化学式为RCl,B项正确;C.S元素的第三电离能约为第二电离能的5.5倍,明显大于其它相邻电离能的倍数,所以S原子最外层最可能是2个电子,又因S原子第一电离能较小,所以S原子易显+2价,它的氯化物的化学式最可能是SCl2,C项错误;D.T元素的第四电离能大约是第三电离能的4.3倍,明显大于其它相邻电离能的倍数,故T原子最外层最可能是3个电子,又因T元素的第一电离能较小,所以T易显+3价,其氯化物的化学式最可能是TCl3,D项错误;E.由(1)分析可知U原子最外层只有1个电子,且第一电离能很小,说明U原子易失去1个电子显+1价,所以其氯化物的化学式为UCl,E项错误;答案选B。
(3) S元素的第三电离能约为第二电离能的5.5倍,明显大于其它相邻电离能的倍数,所以S原子最外层最可能是2个电子(核外电子数越过2个,不可是He),S元素最外层能级上电子排布是ns2,所以S元素最可能是s区。答案选A。
(4)由表格数据可知,Q元素的第一电离能特别大,说明Q原子很难失去电子,化学性质很稳定,所以只有稀有气体元素氦的化学性质和物理性质最像Q元素,答案选E。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】微生物燃料电池在净化废水的同时能获得能源或得到有价值的化学产品,图1为其工作原理,图2为废水中Cr2O72-离子浓度与去除率的关系。下列说法不正确的是

A. M为电源负极,有机物被氧化
B. 处理1 mol Cr2O72-时有6 mol H+从交换膜左侧向右侧迁移
C. 电池工作时,N极附近溶液pH增大
D. Cr2O72-离子浓度较大时,可能会造成还原菌失活
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求答题
(一)现有下列七种物质:①铝 ②蔗糖 ③CO2 ④H2SO4 ⑤Ba(OH)2 ⑥红褐色的氢氧化铁胶体 ⑦HCl ⑧冰水混合物 ⑨碳酸钙 ⑩CuSO4·5H2O。
(1)上述物质中属于电解质的有__________(填序号)。
(2)向⑥的溶液中逐渐滴加⑦的溶液,看到的现象是________________________。
(3)上述物质中有两种物质在水溶液中发生反应,其离子方程式为:H++OH-=H2O,则该反应的化学方程式为______________________________。
(二)(1)某气态氧化物化学式为RO2,在标准状况下,1.28 g该氧化物的体积是448 mL,则氧化物的摩尔质量为_______,R的相对原子质量为__________。
(2)在标准状况下,w L氮气含有x个N2分子,则阿伏加德罗常数为____________(用w,x表示)。
(3)过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的BaCl2溶液;②加入稍过量的NaOH溶液;③加入稍过量的Na2CO3溶液;④滴入稀盐酸至无气泡产生;⑤过滤。正确的操作顺序是________(填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁分别是Na2CO3溶液、AgNO3溶液、BaCl2 溶液、盐酸四种无色溶液中的一种,现进行了如图所示的实验。

(1)通过上述实验判断出各物质:甲___、乙___、丙___、丁____。写出甲与乙反应的离子方程式:___。
(2)实验室有一瓶标签破损(如图所示)的固体试剂。某同学应用(1)中的BaCl2溶液检验,取试剂瓶中的固体少量于试管中,加适量蒸馏水溶解,在所得溶液中加入过量BaCl2溶液,得到白色沉淀。由此,该同学推断这瓶试剂是硫酸钠。你认为他的结论是否正确? _____(填“正确”或“不正确”)。若正确,请写出相应反应的离子方程式__________;若不正确, 请说明可能的结论:_______(填物质的化学式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图所示装置制备KClO溶液,再用KClO溶液与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4。

已知:Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3;K2FeO4易溶于水、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。
回答下列问题:
(1)仪器a的名称___________,装置C中三颈瓶置于冰水浴中的目的是______________________。
(2)装置B吸收的气体是____________(写化学式),装置D的作用是____________________。
(3)装置C中得到足量KClO后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,控制水浴温度为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),反应的离子方程式为____________________。再加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品。
(4)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯方法为:将一定量的K2FeO4粗产品溶于冷的3 mol·L-1KOH溶液中,过滤,将盛有滤液的烧杯______________________,搅拌、静置、过滤,用乙醇洗涤固体2~3次,最后将固体放在真空干燥箱中干燥。
(5)测定K2FeO4产品纯度。称取K2FeO4产品0.2100 g于烧杯中,加入足量的强碱性亚铬酸盐溶液,反应后再加稀硫酸调节溶液呈强酸性,配成250 mL溶液,取出25.00 mL放入锥形瓶,用0.01000 mol·L-1的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗标准溶液30.00 mL[已知:Cr(OH)4-+FeO42-=Fe(OH)3↓+CrO42-+OH-,2CrO42-+2H+=Cr2O72-+H2O,Cr2O72-+6Fe2++14H+=6Fe3++3Cr3++7H2O]。则K2FeO4产品的纯度为_________ %(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物与人类生活密不可分,生活中的一些问题常涉及化学知识。
(1)有下列几种食品:

①花生油中所含人体所需的主要营养物质为___________(填“糖类”、“油脂”或“蛋白质”)。
②吃饭时,咀嚼米饭一会儿后感觉有甜味,是因为淀粉发生了_____________(填字母)反应。
A.分解 B.水解 C.裂解
(2)在日常生活中,下列做法错误的是________。
A.用燃烧法鉴别毛织品和棉织品
B.用纯碱洗涤锅盖上的油渍
C.用闻气味的方法鉴别白酒和米醋
D.用淀粉溶液鉴别加碘食盐和不含碘的食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O![]() H++OH-;ΔH>0,下列叙述正确的是
H++OH-;ΔH>0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量盐酸,平衡逆向移动,c(OH-)增大
D.将水加热,Kw增大,pH不变,呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟化钙材料具有良好的透光性和较低的折射率,可用做紫外和红外光学元件、不可见光谱范围内的消色差镜头。如图为氟化钙晶胞,其中小球代表Ca2+,大球代表F-。
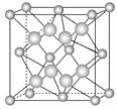
(1)每个晶胞实际含有________个Ca2+和________个F-。
(2)氟化钙晶体可以看作Ca2+按__________堆积排列,F-填入Ca2+堆积的部分空隙中。每个Ca2+周围有__________个F-,而每个F-周围有_________个Ca2+,每个F-周围与其距离最近的F-的数目是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水占地球总储水量的97.2%,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。
(1)海水中存在大量的氯化钠,氯化钠中的金属元素位于元素周期表第________族。
(2)目前,国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸气,蒸气经冷却而得高纯度淡水。由此可判断蒸馏法是________________(填“物理变化”或“化学变化”)。
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应式:食盐+H2O―→NaOH+H2↑+Cl2↑(未配平),该反应中食盐的化学式是________________________;利用电解所得气体制36.5%的浓盐酸1 000 t,最少需消耗食盐________ t。
(4)近年来,有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法。该方法流程如下:

请写出②④的化学反应方程式:______,________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com