
| A. | 2种 | B. | 5种 | C. | 6种 | D. | 8种 |
分析 仅含碳,氢,氧三种元素的某化合物,其相对分子质量小于100,且氧的质量分数为18.18%,分子中N(O)<$\frac{100×18.18%}{16}$=1.32,因此该化合物的分子式中含有1个O,去掉1个O原子后剩余基团总式量为$\frac{16}{18.18%}$-16=72,则最大碳原子数目=$\frac{72}{12}$=6,则该有机物含有5个C原子、12H原子,分子式为C5H12O,该化合物不与钠反应,不含醇羟基,属于醚,再根据烃基异构进行分析解答.
解答 解:仅含碳,氢,氧三种元素的某化合物,其相对分子质量小于100,且氧的质量分数为18.18%,分子中N(O)<$\frac{100×18.18%}{16}$=1.32,因此该化合物的分子式中含有1个O,去掉1个O原子后剩余基团总式量为$\frac{16}{18.18%}$-16=72,则最大碳原子数目=$\frac{72}{12}$=6,则该有机物含有5个C原子、12H原子,分子式为C5H12O,该化合物不与钠反应,不含醇羟基,属于醚,
当一个烃基为-CH3、另外烃基为-CH2CH2CH2CH3,-CH(CH3)CH2CH3,-C(CH3)3,-CH2CH(CH3)2,
当一个烃基为-CH2CH3,另外烃基为-CH2CH2CH3,-CH(CH3)2,
故符合条件的同分异构体共有6种,
故选C.
点评 本题考查有机物推断、同分异构体书写,侧重考查学生分析计算能力,注意利用残余法、商余法确定有机物分子式,同分异构体判断中可以利用形成醚的醇分析,难度中等.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 石英可用于制作光导纤维,光导纤维遇强碱会“断路” | |
| C. | 清晨阳光穿过林木枝叶铺洒地面属于丁达尔现象 | |
| D. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4Fe2++2I-+3Cl2═4Fe3++I2+6Cl- | |
| B. | 2I-+Cl2═2Cl-+I2 | |
| C. | 2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| D. | 2Fe2++2I-+2Br-+3Cl2═2Fe3++I2+Br2+6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
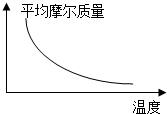 可逆反应2A+B?2C(g)(正反应放热),随温度变化气体平均摩尔质量如图所示,则下列叙述正确的是( )
可逆反应2A+B?2C(g)(正反应放热),随温度变化气体平均摩尔质量如图所示,则下列叙述正确的是( )| A. | A和B可能都是固体 | B. | A和B一定都是气体 | ||
| C. | 若B为固体,则A一定是气体 | D. | A和B不可能都是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,加水稀释0.01mol•L-1的氨水,c(NH4+)•c(OH-)逐渐增大 | |
| B. | 在H2SO3溶液中滴加少量NaClO溶液,c(SO32-)逐渐增大 | |
| C. | 在H2S溶液中滴加CuSO4溶液,H2S的电离程度逐渐增大 | |
| D. | 微热醋酸溶液,$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$保持不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com