
| A. | 离子半径:O2->Na+>Mg2+>Al3+>F- | |
| B. | 热稳定性:HCl>H2S>PH3>AsH3 | |
| C. | 酸性强弱:H2SiO3<H2CO3<H3PO4<H2SO4 | |
| D. | 碱性强弱:KOH>NaOH>Mg(OH)2>Al(OH)3 |
分析 A.电子层结构相同时,原子序数越大,半径越小;
B.元素的非金属性越强,对应的氢化物越稳定;
C.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
D.元素的金属性越强,对应的最高价氧化物的水化物的碱性越强.
解答 解:A.电子层结构相同时,原子序数越大,半径越小,则离子半径:O2->F->Na+>Mg2+>Al3+,故A错误;
B.非金属性Cl>S>P>As,元素的非金属性越强,对应的氢化物越稳定,所以热稳定性:HCl>H2S>PH3>AsH3,故B正确;
C.非金属性Si<C<P<S,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,所以酸性:H2SiO3<H2CO3<H3PO4<H2SO4,故C正确;
D.金属性:K>Na>Mg>Al,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,所以碱性强弱:KOH>NaOH>Mg(OH)2>Al(OH)3,故D正确.
故选A.
点评 本题考查元素周期律知识,侧重于学生的分析能力和基本概念的理解和运用的考查,注意元素的性质与对应单质、化合物的关系,把握元素周期律的递变规律是解答该类题目的关键,难度不大.


科目:高中化学 来源: 题型:填空题
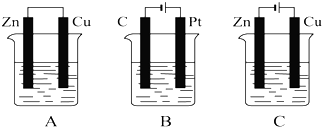
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
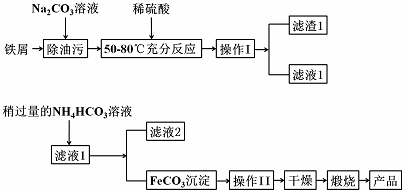
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用NaCl配成一定物质的量浓度溶液 | B. | HCl溶于水 | ||
| C. | 水变成水蒸气 | D. | (NH4)2CO3加强热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
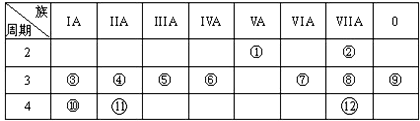
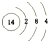 ,写出①的气态氢化物分子的电子式
,写出①的气态氢化物分子的电子式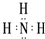 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯分子有8个σ键,1个π键 | |
| B. | 丙烯分子中3个碳原子都是sp3杂化 | |
| C. | 丙烯分子中只存在极性键 | |
| D. | 丙烯分子中3个碳原子在同一直线上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com