
| A. | 常温下,pH=7的NH4Cl和NH3•H2O的混合溶液中:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| B. | pH=12的氨水与pH=2的盐酸等体积混合溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| C. | 25℃时,0.1 mol•L-1pH=4.5的NaHSO3溶液中:c(HSO3-)>c(H2SO3)>c(SO32-) | |
| D. | 常温下,等浓度的CH3COONa和CH3COOH混合溶液:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
分析 A.溶液为中性,则c(OH-)=c(H+),根据电荷守恒可知c(Cl-)=c(NH4+);
B.氨水为弱碱,则混合液中氨水过量,溶液显示碱性:c(OH-)>c(H+),根据电荷守恒可知c(NH4+)>c(Cl-);
C.0.1 mol•L-1pH=4.5的NaHSO3溶液呈酸性,说明HSO3-的电离程度大于其水解程度,则c(SO32-)>c(H2SO3);
D.根据混合液中的物料守恒和电荷守恒进行分析.
解答 解:A.常温下,pH=7的NH4Cl和NH3•H2O的混合溶液中,液为中性,则c(OH-)=c(H+),根据电荷守恒可知c(Cl-)=c(NH4+),溶液中离子浓度大小为:c(Cl-)=c(NH4+)>c(OH-)=c(H+),故A正确;
B.pH=12的氨水与pH=2的盐酸等体积混合,氨水过量,溶液显示碱性:c(OH-)>c(H+),根据电荷守恒可知c(NH4+)>c(Cl-),溶液中离子浓度大小为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),故B正确;
C.25℃时,0.1 mol•L-1pH=4.5的NaHSO3溶液显示酸性,说明HSO3-的电离程度大于其水解程度,则c(SO32-)>c(H2SO3),正确的离子浓度大小为:c(HSO3-)>c(SO32-)>c(H2SO3),故C错误;
D.等浓度的CH3COONa和CH3COOH混合溶液,根据电荷守恒可知:c(CH3COO-)+c(OH-)=c(H+)+c(Na+),根据物料守恒可得:c(CH3COO-)+c(CH3COOH)=2c(Na+),二者结合可得:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)],故D正确;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理的含义为解答关键,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 3.2gO2和O3混合气体所含的氧原子总数为0.2NA | |
| B. | 一定条件下,2 mol SO2和1mol O2在密闭容器中充分反应后,容器内气体分子总数为2NA | |
| C. | 12g金刚石含4NA个C-C键 | |
| D. | 0.1 mol Na在空气中完全燃烧生成Na2O2,转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
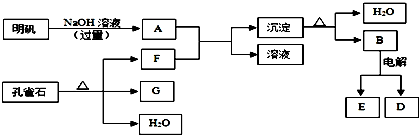
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
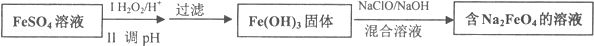
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 | |
| B. | 中、美、日等国已掌握的陶瓷发动机技术,能较大程度地降低能耗,节约能源 | |
| C. | 光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅 | |
| D. | 结构陶瓷碳化硼(B4C3)常用于制造切削工具,它是一种新型无机非金属材料,属于原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
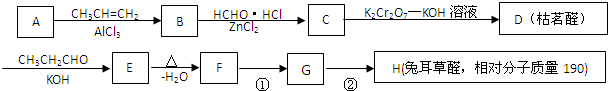
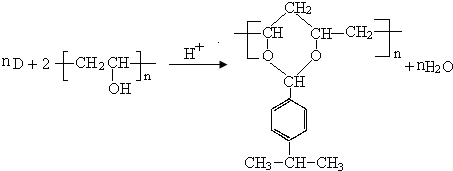
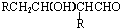 $→_{-H_{2}O}^{△}$
$→_{-H_{2}O}^{△}$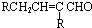
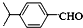 .
.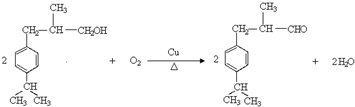 .
.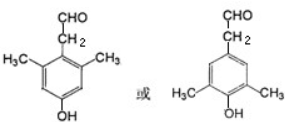 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定有Al3+、Mg2+、NH4+、SO32-、Br | B. | 肯定有Mg2+、Br-、HCO3-、SO42- | ||
| C. | 肯定无Ag+、Cl-、I-、AlO2-、MnO4 | D. | 可能有K+、Cl-、SO42-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在t1、t3℃时,NaCl和MgSO4的溶解度相等 | |
| B. | t2~t3℃,MgSO4的溶解度随温度升高而增大 | |
| C. | 在t2℃时,MgSO4饱和溶液的溶质质量分数最大 | |
| D. | 把MgSO4饱和溶液的温度从t2℃升至t3℃时,有晶体析出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com