
| A. | N2(g)+3H2(g)?2NH3(g)[在混合气体中φ(NH3)=33.3%] | |
| B. | CO(g)+H2O(g)?CO2(g)+H2(g)(在恒容容器中,容器内压强不再改变) | |
| C. | 2SO2(g)+O2(g)?2SO3(g)(在恒压条件下,总质量不再改变) | |
| D. | 2NO2(g)?2NO(g)+O2(g)(在恒容条件下,气体颜色不再改变) |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A.在混合气体中φ(NH3)=33.3%,并不是不变的状态,可能是平衡状态,也可能不是平衡状态,故A错误;
B.CO(g)+H2O(g)?CO2(g)+H2(g)反应的两边气体的体积相同且都是气体,压强始终不变,所以压强不变无法判断是否达到平衡状态,故B错误;
C.2SO2(g)+O2(g)?2SO3(g)反应的两边都是气体,容器的容积不变,所以在恒压条件下,总质量始终不变,无法判断乙是否达到平衡状态,故C错误;
D.混合气体的颜色不再改变,即二氧化氮的浓度不变,说明达平衡状态,故D正确;
故选D.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 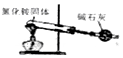 实验室用如图装置来制取NH3 | B. | 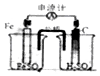 实验如图碳棒上有无色气泡产生 | ||
| C. | 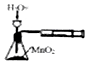 实验如图定量测定H2O2的分解速率 | D. |  实验如图检验钾元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自来水厂用明矾净水,用Fe2(SO4)3或ClO2均能代替明矾净水 | |
| B. | 青篙素在超临界CO2中有很强的溶解性,萃取青蒿素可用超临界CO2作萃取剂 | |
| C. | 用石灰水或MgSO4溶液喷涂在树干上均可消灭树皮上的过冬虫卵 | |
| D. | 新型材料聚碳酸酯纤维、石墨烯纤维都属于有机高分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HF、NH3、SiH4依次增大 | |
| B. | 原子半径:C、Al、K依次增大 | |
| C. | 酸碱性:NaOH、Al(OH)3、Mg(OH)2碱性减弱 | |
| D. | 非金属性:Cl、S、P依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )| 选项 | a分液漏斗中的物质 | b圆底烧瓶中的物质 | c集气瓶中收集的气体 | d烧杯中的物质 |
| A | 浓氨水 | CaO | NH3 | H2O |
| B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
| C | 稀硝酸 | Cu | NO2 | H2O |
| D | 稀盐酸 | MnO2 | Cl2 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验步骤 | 实验操作 | 现象 | 实验结论 |
| 1 | ① | ② | NaNO2具有氧化性 |
| 2 | ③ | ④ | NaNO2具有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学反应速率和限度与生产、生活密切相关.
化学反应速率和限度与生产、生活密切相关.| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com