
下列物质属于纯净物的是
A.冰水混合物 B.无污染的空气 C.盐酸 D.漂白粉
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014江苏省海门市第一学期期末教学质量调研高一化学试卷(解析版) 题型:选择题
对于反应3Cl2+6NaOH 5NaCl+NaClO3+3H2O,以下叙述正确的是
5NaCl+NaClO3+3H2O,以下叙述正确的是
A.Cl2是氧化剂,NaOH是还原剂
B.当有6.72L Cl2反应时,转移电子物质的量为0.5mol
C.氧化剂得电子总数与还原剂失电子总数之比为1∶1
D.被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省无锡市高一下学期期末考试化学试卷(解析版) 题型:选择题
某两种气态烃组成的混合物,取其2.24L(标准状况下)充分燃烧,得到0.16mol二氧化碳气体和3.6g液态水。据此判断下列分析中不正确的是
A.此气体中一定含有甲烷
B.此混合气体中可能含有乙烷
C.此混合气体中一定不含有丙烷
D.此气体若是乙烯与甲烷的混合气体,则甲烷与乙烯的体积比为2∶3
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省无锡市高一下学期期末考试化学试卷(解析版) 题型:选择题
下列关于有机物存在的叙述,错误的是
A.工业酒精中含有乙醇和甲醇 B.煤中含有苯和甲苯
C.天然油脂中含有高级脂肪酸甘油酯 D.许多水果中含有酯类化合物
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高一期末模拟化学试卷(解析版) 题型:选择题
有一镁、铝合金,用适量稀硫酸恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠的体积关系如图所示,则原合金中镁、铝物质的量比为

A.2∶1 B.4∶1 C.1∶1 D.1∶2
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高一期末模拟化学试卷(解析版) 题型:选择题
能证明硅酸的酸性弱于碳酸酸性的实验事实是
A.CO2溶于水形成碳酸,SiO2难溶于水
B.CO2通入可溶性硅酸盐中析出硅酸沉淀
C.高温下SiO2与碳酸盐反应生成CO2
D.HCl通入可溶性碳酸盐溶液中放出气体,氯化氢通入可溶性硅酸盐溶液中生成沉淀
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高二下学期阶段测试5月 化学试卷(解析版) 题型:填空题
(14分)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)  (NH4)2CO3(aq)ΔH1
(NH4)2CO3(aq)ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)  NH4HCO3(aq)ΔH2
NH4HCO3(aq)ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)  2NH4HCO3(aq)ΔH3
2NH4HCO3(aq)ΔH3
请回答下列问题:
(1)ΔH3与ΔH1、ΔH2之间的关系是:ΔH3= 。
(2) 反应Ⅲ的化学平衡常数表达式为 。
(3)为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,得到趋势图(见图1)。则:
①ΔH3 0(填“>”、“=”或“<”)。
②在T1~T2及T4~T5两个温度区间,容器内CO2气体浓度呈现如图1所示的变化趋势,其原因是
。
③反应Ⅲ在温度为T1时,溶液pH随时间变化的趋势曲线如图2所示。当时间到达t1时,将该反应体系温度迅速上升到T2,并维持该温度。请在该图中画出t1时刻后溶液的pH变化总趋势曲线。
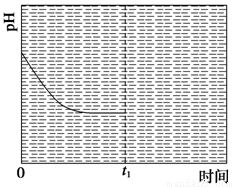
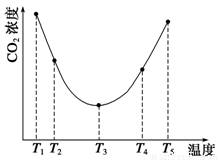
图1 图2
(4)利用反应Ⅲ捕获CO2,在(NH4)2CO3初始浓度和体积确定的情况下,提高CO2吸收量的措施有
。
(5)下列物质中也可以作为CO2捕获剂的是 。
A.NH4Cl B.Na2CO3 C.HOCH2CH2OH D.HOCH2CH2NH2
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高三模拟考试化学试卷(解析版) 题型:填空题
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
(1)C、Si、N元素的电负性由大到小的顺序是 ,
C60和金刚石都是碳的同素异形体,二者相比,熔点高的是 ,原因是 。
(2)A、B均为短周期金属元素,依据表中数据,写出B的基态原子的电子排布式: 。
电离能/(kJ·mol-1) | I1 | I2 | I3 | I4 |
A | 932 | 1 821 | 15 390 | 21 771 |
B | 738 | 1 451 | 7 733 | 10 540 |
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,d0或d10排布无颜色,d1~d9排布有颜色。如[Co(H2O)6]2+显粉红色。据此判断:
[Mn(H2O)6]2+ (填“无”或“有”)颜色。
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①COCl2分子的结构式为 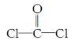 ,每个COCl2分子内含有 个σ键, 个π键,其中心原子采取 杂化轨道方式。
,每个COCl2分子内含有 个σ键, 个π键,其中心原子采取 杂化轨道方式。
②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g)。反应过程中,断裂的化学键只有配位键,则形成的化学键类型是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三考前模拟化学试卷(解析版) 题型:选择题
化学与材料、生活和环境密切相关。下列说法不正确的是
A.“地沟油”禁止食用,但可用来制造肥皂
B.煤经过气化或液化处理,可获得清洁能源等
C.塑料、聚酯纤维和光导纤维都属有机高分子材料
D.开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com