
【题目】在一定温度下的恒容容器中,.当下列物理量不再发生变化时,不能表明反应:A(s)+3B(g)![]() 2C(g)+D(g)已达平衡状态的是( )
2C(g)+D(g)已达平衡状态的是( )
①气体的平均相对分子质量不再变化;②单位时间内生成amolA,同时消耗2amolC;③容器中的压强不再变化;④混合气体的密度不再变化;⑤B的浓度不再变化;⑥n(A):n(B):n(C):n(D)=1:3:2:2
A.②③⑤B.①③④⑥C.②④⑤D.②③⑥
【答案】D
【解析】
该反应为等体积,且有固体参加的反应。
①气体的平均相对分子质量![]() ,正向反应,气体质量变大,气体物质的量没变,M变大,当不再改变即为为平衡,故正确;
,正向反应,气体质量变大,气体物质的量没变,M变大,当不再改变即为为平衡,故正确;
②单位时间内生成amolA,是逆方向,同时消耗2amolC,也是逆方向,同一个方向不能说明达到平衡,故错误;
③该反应是等体积反应,容器中的压强不变,不能作为平衡的标志,故错误;
④混合气体的密度![]() ,正向移动,气体质量变大,容器体积不变,密度始终变大,当密度不变即为平衡,故正确;
,正向移动,气体质量变大,容器体积不变,密度始终变大,当密度不变即为平衡,故正确;
⑤B的浓度不再变化,能作为判断平衡的标志,故正确;
⑥n(A):n(B):n(C):n(D)=1:3:2:2,只能的各物质的量不再改变,不能说之比等于多少,故错误;因此②③⑥不能作为判断平衡的标志;
综上所述,答案为D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】标出下列反应电子转移的方向和总数:
2Fe(NO3)3 + 16NaOH + 3Cl2 → 2Na2FeO4 + 6NaNO3 + 6NaCl + 8H2O________________
(1)反应中______元素被氧化, 还原剂是__________, 还原产物是_______,发生还原反应的物质是_________
(2)若反应中转移了0.2 mol电子,则消耗了_______L Cl2(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5molL-1NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。下列叙述不正确的是( )
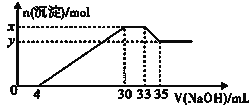
A.x-y=0.01molB.原溶液中c(Cl-)=0.75mol/L
C.原溶液的c(H+)=0.1mol/LD.原溶液中n(Mg2+):n(Al3+)=5:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用胆矾(CuSO45H2O)配制0.1mol/L的硫酸铜溶液,正确的操作是_______
A.将胆矾加热除去结晶水后,称取16g溶解在1L水中
B.称取25g胆矾溶于水,然后将此溶液稀释至1L
C.称取25g胆矾溶解在1L水里
D.将16g胆矾溶于水,然后将此溶液稀释至1L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g)+I2(g)![]() 2HI(g) ΔH=-akJ/mol,已知(a、b、c均大于零),下列说法正确的是( )
2HI(g) ΔH=-akJ/mol,已知(a、b、c均大于零),下列说法正确的是( )

A.反应物的总能量低于生成物的总能量
B.断开1molH—H键和1molI—I键所需能量大于断开2 molH—I键所需能量
C.断开2mol H—I键所需能量约为(c+b+a)kJ
D.向密闭容器中加入2molH2和2molI2,充分反应后放出的热量等于2akJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上研究高效处理煤燃烧释放出来的SO2,有利于减小环境污染。在T℃时,利用CO处理SO2的反应为:2CO(g)+SO2(g)![]() 2CO2(g)+S(l) △H=akJ/mol;
2CO2(g)+S(l) △H=akJ/mol;
(1)已知T℃时:C(s)+![]() O2(g)=CO(g) △H1=-110.5kJ/mol
O2(g)=CO(g) △H1=-110.5kJ/mol
S(l)+O2(g)=SO2(g) △H2=-290.0kJ/mol
C(s)+O2(g)=CO2(g) △H3=-390.0kJ/mol
则T℃时,a=___。
(2)在T℃下,将1.4molCO和1molSO2通入2L恒容容器中发生上述反应,反应体系气体总物质的量随时间变化如图;在0~10min,反应的平均速率v(CO)=___,SO2的平衡转化率![]() (SO2)=___%;在T℃时该反应的平衡常数Kc=___L/mol。
(SO2)=___%;在T℃时该反应的平衡常数Kc=___L/mol。
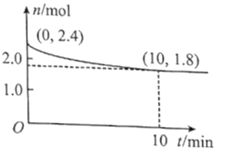
(3)实验测得:v正=v(CO)消耗=k正c(CO)c(SO2),v逆=v(CO2)消耗=k逆![]() ,k正、k逆为只受温度影响的速率常数。若将(2)中容器内的温度升高(假设各物质的状态不发生变化),
,k正、k逆为只受温度影响的速率常数。若将(2)中容器内的温度升高(假设各物质的状态不发生变化),![]() 的值将___(填“增大”、“减小”或“不变”)。
的值将___(填“增大”、“减小”或“不变”)。
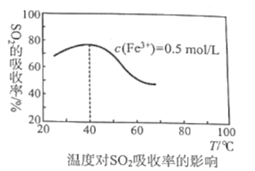
(4)某科研团队研究用Fe2(SO4)3(aq)处理SO2:Fe3+溶液吸收SO2发生的离子反应方程式为___;其他外界条件不变下,在相同时间内温度对SO2吸收率的影响结果如图,在40℃前,SO2的吸收率随温度变化的可能原因是___;在40℃后,SO2的吸收率发生的变化是温度升高该反应逆向移动的结果,导致反应逆向移动的原因:一是该反应为放热反应,二是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用下面所示装置制取氯酸钾、次氯酸钠和氯水并进行探究实验。
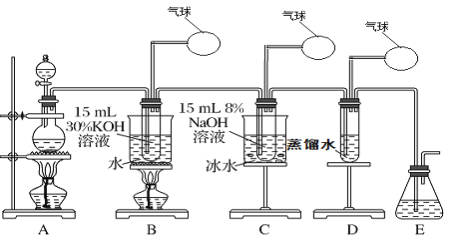
实验Ⅰ.制取氯酸钾(KClO3)、次氯酸钠、氯水
(1)写出装置A实验室制取Cl2的化学反应方程式_________________________
(2)制取实验结束后,取出装置B中的试管,冷却结晶、过滤、洗涤,该实验操作过程需要的玻璃仪器有胶头滴管、烧杯、________、________。
(3)写出B中制备氯酸钾(KClO3)的方程式____________________
(4)装置C中反应需要在冰水浴中进行,其原因是_____________________________
资料:SO2是一种酸性氧化物,与CO2相似,2NaOH(过量)+SO2=Na2SO3+H2O ,SO32-是还原性很强的离子,在溶液中与氧化性强的离子不能大量共存,易被氧化成SO42—。
实验Ⅱ.尾气处理
实验小组利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(5)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和![]()
请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中的CO2的影响)。
①提出合理假设:
假设1:只存在![]() ;
;
假设2:既不存在![]() 也不存在ClO-;
也不存在ClO-;
假设3:______________________________。
②设计实验方案,进行实验。请在表中写出实验步骤以及预期现象和结论。
限选实验试剂:3mol·L-1 H2SO4、1mol·L-1 NaOH溶液、0.01mol·L-1酸性KMnO4溶液、淀粉、KI溶液。
实验步骤 | 预期现象和结论 |
步骤1:取少量吸收液分置于A、B试管中 | |
步骤2:向A试管中滴加0.01 mol·L-1酸性KMnO4溶液 | (1)若溶液褪色,则假设1成立 (2)若溶液不褪色,则假设2或3成立 |
步骤3:____________________________________ | __________________________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组拟用铅蓄电池为直流电源,进行电絮凝净水的实验探究,设计的实验装置如图所示。下列说法正确的是
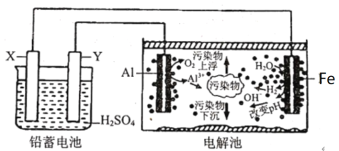
A.Y电极反应为Pb+SO42--2e-=PbSO4
B.每消耗103.5gPb, 理论上电解池阴极上有1molH2生成
C.该电解池的总反应为2Al+6H2O![]() 2Al(OH)3+3H2↑
2Al(OH)3+3H2↑
D.若污水为含有Cr2O72-工业酸性废水,为将其转化为Cr3+除去,可让铁电极连接铅蓄电池的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲、乙、丙、丁、戊五种烃,已知他们是C2H6、C3H6、C2H2、C6H6、C6H12(环己烷),实验现象如下:
①甲、乙能使溴水因化学反应而褪色;②0.5mol甲能与1molH2生成丙,丙不能使溴水和酸性高锰酸钾溶液褪色;③戊可由丁在一定条件下与氢气反应得到。④比乙少一个碳原子的相邻同系物可以在一定条件下和H2O反应得到W,W和醋酸反应会生成一种有香味的油状液体。
(1)这五种烃分别是:甲是____(写电子式);乙是____(写结构简式);丙是____(写结构式);丁是____(写名称)。
(2)写出下列化学方程式:
乙和溴水的反应:______。
实验室制备甲的反应:______。
④中制得香味油状液体的反应:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com