
有Fe2+、NO3-、Fe3+、NH4+、H+ 和H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是( )
A.氧化剂与还原剂的物质的量之比为8:l
B、还原产物为NH4+
C.若有l mol NO3-参加还原反应,则转移8mol e-
D.若把该反应设计为原电池,则负极反应为Fe 2+-e-=Fe 3+
 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源:2015-2016学年黑龙江省高二上期末考试化学试卷(解析版) 题型:填空题
甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g) △H1=﹣116kJ•mol﹣1
CH3OH(g) △H1=﹣116kJ•mol﹣1
(1)下列措施中有利于增大该反应的反应速率且利于反应正向进行的是___________。
a.随时将CH3OH与反应混合物分离 b.降低反应温度
c.增大体系压强 d.使用高效催化剂
(2)已知:CO(g)+ O2(g)═CO2(g) △H2=﹣283kJ•mol﹣1
O2(g)═CO2(g) △H2=﹣283kJ•mol﹣1
H2(g)+ O2(g)═H2O(g) △H3=﹣242kJ•mol﹣1
O2(g)═H2O(g) △H3=﹣242kJ•mol﹣1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为________________________。
(3)在容积为2L的恒容容器中,分别研究在三种不同温度下合成甲醇,右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为2mol)与CO平衡转化率的关系.请回答:
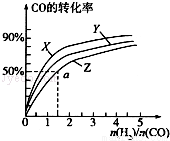
①在图中三条曲线,对应的温度由高到低的顺序是_________________。
②利用a点对应的数据,计算出曲线Z在对应温度下CH3OH(g) CO(g)+2H2(g)的平衡常数:K=_______________。
CO(g)+2H2(g)的平衡常数:K=_______________。
(4)恒温下,分别将1molCO和2molH2置于恒容容器I和恒压容器Ⅱ中(两容器起始容积相同),充分反应.
①达到平衡所需时间是I_________Ⅱ(填“>”、“<”或“=”,下同).达到平衡后,两容器中CH3OH的体积分数关系是I________Ⅱ。
②平衡时,测得容器I中的压强减小了30%,则该容器中CO的转化率为_______。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上期末考试化学试卷(解析版) 题型:填空题
(1)乙醇的分子结构如右图: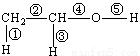 ,其中①②③④⑤表示化学键的代号,用代号回答:
,其中①②③④⑤表示化学键的代号,用代号回答:
i乙醇与钠反应断裂的键是_
ii乙醇与氧气在铜或银作催化剂,加热条件下反应断裂的键是
(2)把一端弯成螺旋状的铜丝放在酒精灯外焰部分加热,看到铜丝表面变成 色。趁热将它反复插入盛乙醇的试管中,铜丝表面又变成 色,并有 气味的物质生成,总反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2016届河北省衡水市高三上一轮复习检测二化学试卷(解析版) 题型:选择题
某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)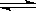 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( )
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( )
A.m=2 B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1:1 D.第二次平衡时,Z的浓度为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2016届河北省衡水市高三上一轮复习检测一化学试卷(解析版) 题型:选择题
0.1mol下列气体分别与1L0.lmol·L-1的NaOH溶液反应,形成的溶液pH最小的是( )
A.NO2 B.SO2 C.SO3 D.CO2
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三上12月月考化学试卷(解析版) 题型:实验题
某学习小组利用下列装置进行 CO2与饱和 Na2CO3溶液反应制备 NaHCO3。
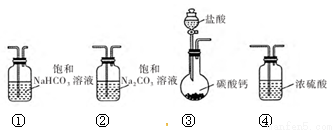
(1)选取必要的实验装置,正确的连接顺序为 (填序号)。
(2)为确定制得的固体样品是纯净的 NaHCO3,小组同学提出下列实验方案:
甲方案:将样品溶液与饱和澄清石灰水反应,观察现象。
乙方案:将样品溶液与 BaCl2溶液反应,观察现象。
丙方案:测定 pH 法。
丁方案:热重分析法。
①判定甲方案 (填“可行”或“不可行”)。
②为判定乙方案的可行性,某同学用 NaHCO3分析纯配制的溶液,与 BaCl2溶液等体积混合进行实验,结果如下。
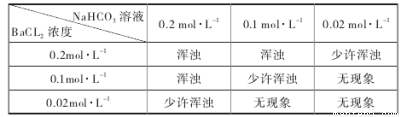
(i)此实验已可说明乙方案是不可行的。请结合以下数据,并通过计算说明产生浑浊的原因。答:__________________________________________________________。
[已知:0.1mol·L-1NaHCO3溶液电离出的 c(CO32-) 为0.0011mol·L-1,Ksp(BaCO3)=5.1×10-9]
(ii)产生浑浊的离子方程式_______________________________________。
③使用 pH 计测定的丙方案是______________________________________________。
④进行丁方案实验,得到不同升温速率下的热重曲线如下图。
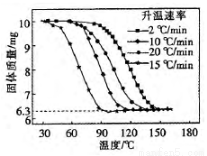
(i)样品的纯度为_________________。
(ii)升温速率对实验结果______________(填“有较大”、“有较小”或“没有”)影响。
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三上期末化学试卷(解析版) 题型:选择题
下列离子方程的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2mol Cl2通入到含1mol FeI2的溶液中: 2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Mg(HCO3)2溶液与足量的NaOH溶液反应: Mg2++HCO3-+OH-=MgCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入到NaClO溶液中: SO2+H2O+ClO-=HClO+HSO3- | 正确;说明酸性: H2SO3强于HClO |
D | 1mol/L的NaAlO2溶液和2.5mol/L的HCl溶液等体积互相均匀混合:2AlO2-+5H+=Al3++Al(OH)3↓+H2O | 正确;AlO2-与Al(OH)3消耗的H+的物质的量之比为2:3 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高一上期末考试化学试卷(解析版) 题型:计算题
把19.2g的Cu放入足量的稀硝酸中,至Cu完全反应。已知:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,求:
(1)参加反应的硝酸的物质的量是多少?
(2)反应结束后溶液加水到500mL,这时硝酸铜的物质的量浓度是多少?
(3)生成的NO在标准状况下的体积是多少升?
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上第四次摸底考试化学试卷(解析版) 题型:选择题
在含有0.06 mol Cl-、0.07 mol SO42 -及一定量Mg2+和Al3+的混合溶液中,滴入2 mol/L NaOH溶液,产生沉淀情况如图。若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x(不考虑Mg2+和Al3+水解及水的电离)。则下列说法错误的是
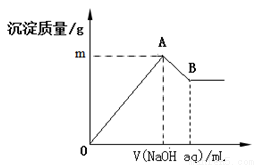
A.a的取值范围是0<a<1/15
B.图中m的取值范围5.2~5.8
C.A、B两点横坐标的数值均随x变化而变化
D.若B点横坐标数值为120 ,则a=0.04
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com