
【题目】下列实验误差分析错误的是
A. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
B. 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
C. 用润湿的pH试纸测稀碱溶液的pH,测定值偏小
D. 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小
【答案】A
【解析】分析:A项,用容量瓶配制溶液,定容时俯视刻度线,所配溶液体积偏小,所配溶液浓度偏大;B项,滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小;C项,用湿润pH试纸测稀碱液的pH,c(OH-)偏小,pH测定值偏小;D项,测定中和热时,将碱缓慢倒入酸中,散失热量较多,所测温度值偏小。
详解:A项,用容量瓶配制溶液,定容时俯视刻度线,所配溶液体积偏小,根据公式cB=![]() ,所配溶液浓度偏大,A项错误;B项,滴定前滴定管内无气泡,终点读数时有气泡,终点读数偏小,所测体积偏小,B项正确;C项,用湿润pH试纸测稀碱液的pH,c(OH-)偏小,pH测定值偏小,C项正确;D项,测定中和热时,将碱缓慢倒入酸中,散失热量较多,所测温度值偏小,D项正确;答案选A。
,所配溶液浓度偏大,A项错误;B项,滴定前滴定管内无气泡,终点读数时有气泡,终点读数偏小,所测体积偏小,B项正确;C项,用湿润pH试纸测稀碱液的pH,c(OH-)偏小,pH测定值偏小,C项正确;D项,测定中和热时,将碱缓慢倒入酸中,散失热量较多,所测温度值偏小,D项正确;答案选A。


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2(g) ![]() 2NO(g)+O2(g)在一恒容的密闭容器中反应,达到平衡状态的标志是( )
2NO(g)+O2(g)在一恒容的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2 ②单位时间内生成n mol O2的同时生成2n mol NO ③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥混合气体的平均相对分子质量不再改变的状态 ⑦混合气体的压强不再改变的状态
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是

A. 该反应进行到M点放出的热量大于进行到W点放出的热量
B. T2下,在0~t1时间内,υ(Y)=a-b/t1 mol/(L·min)
C. M点的正反应速率υ(正)大于N点的逆反应速率υ(逆)
D. M点时再加入一定量的X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列推断正确的是( )
A. BF3为三角锥形分子
B. NH的电子式为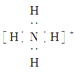 ,离子呈平面正方形结构
,离子呈平面正方形结构
C. CH4分子中的4个C—H键都是氢原子的1s轨道与碳原子的2p轨道形成的s—p σ键
D. CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成C—H σ键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 0.1mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-)
B. Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
C. 在Na2S溶液中加入AgC1固体,溶液中c(S2-)下降
D. pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、为测定金属钠样品(表面有 Na2O)中钠单质的质量分数,设计了如下实验(反应装置如图所示):

①称量 A、B 的总质量
②称取一定质量的钠样品
③将钠样品投入锥形瓶中,迅速塞紧带 U 形干燥管(内含无水 CaCl2 干燥 剂)的橡皮塞 。有关数据是:称取的金属钠样品质量为 a g,A、B 反应前总质量为 b g,反应后 A、B 的总质量为 c g。 请根据题意回答下列问题:
(1)A 中钠和水反应过程可看到钠熔成闪亮的小球,产生这一现象原因是:_____________
(2)用 a、b、c 表示的钠单质的质量分数为_______________
(3)如果没有 B 装置对实验结果有何影响___________。(填“偏大”或“偏小”“不影响”)
Ⅱ、现用金属钠和空气制备纯度较高的 Na2O2,可利用的装置如下图。回答下列问题:


(4)上述装置Ⅳ中盛放的试剂是______,为完成实验应将装置Ⅳ接在_____(填写字母号)。
A.I 之前 B. I 和 II 之间 C. II 和 III 之间 D.III 之后
(5)点燃酒精灯后,观察到装置 II 中的现象为_____。
Ⅲ、现用制得纯度较高的 Na2O2进行相关实验。回答下列问题:
(6)用脱脂棉包住Na2O2粉末,置于石棉网上,通过细管向脱脂棉中吹CO2,脱脂棉_______(填“能”或“不能”)燃烧起来。
(7)盛有0.78 g Na2O2、1.68g NaHCO3的固体混合物放在密闭容器中加热,最后固体质量为_________g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分別取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是___________。
(2)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液変红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为____________。
(3)乙组同学认为甲组的实验不够谨慎,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是__________。
(4)丙组同学取10mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。分別取2mL此溶液于3支武管中进行如下实验:
①第一支试管中加入1mLCCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是_______(填离子符号);实验①和实验③说明:在I-过量的情况下,溶液中仍含有_____(填离子符号);由此可以证明该氧化还原反应为___________。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为________。一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是__________。生成沉淀的原因是______________(用平衡移动原理解释)。
(6)某铁的氧化物(FexO)1.52g溶于足量盐酸中,向所得溶液通入标准状况下112mLCl2,恰好将Fe2+完全氧化,则x值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两烧杯各盛有100 mL 3 mol·L-1的盐酸和氢氧化钠溶液,向烧杯分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲∶乙=3∶4,则加入铝粉的质量为
A. 1.8 g B. 2.7 g C. 3.6 g D. 5.4 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性硼化钒(VB2)一空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5.用该电池为电源,选用情性电极电解硫酸铜溶液,实验装置如图所示。下列说法正确的是

A. VB2电极的电极反应式为:2VB2+11H2O-22e-=V2O5+2B2O3+22H+
B. 外电路中电子由c电极流向VB2电极
C. 电解过程中SO42-向b电极移动
D. 电解过程中,b电极表面有红色物质析出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com