

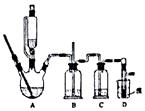
| A. | 用装置甲制取氯气 | |
| B. | 用装置乙使Br-全部转化为溴单质 | |
| C. | 用装置丙分液时先从下口放出水层,再从上口倒出有机层 | |
| D. | 用装置丁将分液后的水层蒸发至干,再灼烧制得无水FeCl3 |
分析 A.1mol/L盐酸为稀盐酸,与二氧化锰不反应;
B.氯气与FeBr3发生氧化还原反应,但图中导管短进可排出液体;
C.溴苯不溶于水,密度比水大;
D.蒸发时促进氯化铁水解,生成盐酸易挥发.
解答 解:A.1mol/L盐酸为稀盐酸,与二氧化锰不反应,则不能制备氯气,故A错误;
B.图中导管的进入方向不合理,将溶液排出装置,则不能将溴离子完全氧化,故B错误
C.溴苯不溶于水,密度比水大,则用装置丙分液时先从下口放出水层,再从上口倒出有机层,故C正确;
D.蒸发时促进氯化铁水解,生成盐酸易挥发,不能得到FeCl3,灼烧得到氧化铁,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、实验装置的作用、混合物分离提纯、盐类水解等为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
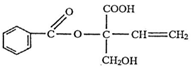
| A. | X的分子式为C12H14O5 | |
| B. | 1molX最多消耗1molNaOH | |
| C. | X在一定条件下能发生取代、加成、加聚、氧化等反应 | |
| D. | X苯环上的二氯代物有7种(不考虑立体异构) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下,PH均为9的CH3COONa和NaOH溶液中,水的电离程度不相同 | |
| B. | 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H>0 | |
| C. | 向浓度均为0.1 mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀,说明Ksp[Mg(OH)2]>Ksp[Cu(OH)2] | |
| D. | 已知I${\;}_{3}^{-}$?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
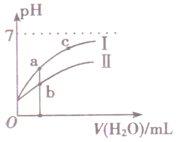 如图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
如图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )| A. | 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 等浓度等体积的CH3COONa和NaClO两种溶液中,阴离子的总物质的量前者小于后者 | |
| C. | 图中a、b两点对应的酸的物质的量浓度a>b | |
| D. | 图中a、c两点的溶液中$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$相等(HR代表CH3COOH或HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室制备1,2-溴乙烷的反应原理如下:
实验室制备1,2-溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度(g/cm3) | 0.79 | 2.2 | 0.71 |
| 沸点(℃) | 78.5 | 132 | 34.6 |
| 熔点(℃) | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
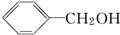 ,B
,B .
. .
. →2
→2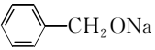 +H2↑.
+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,C和D反应生成的化合物的电子式是
,C和D反应生成的化合物的电子式是 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com