
| A. | 放入0.2mol SO2、0.1molO2、0.1mol SO3,达到平衡时SO3必小于amol | |
| B. | 放入0.2mol SO2、0.1molO2、0.2mol SO3,达到平衡时SO3必大于amol | |
| C. | 放入0.4mol SO2、0.1molO2,达到平衡时SO3会等于0.4amol | |
| D. | 放入0.2mol SO2、0.1molO2,达到平衡时SO3必小于amol |
分析 在一定条件下,将0.2mol SO2和0.2mol SO3气体充入VL密闭容器中,发生反应,2SO2+O2 
A、放入0.2mol SO2、0.1molO2、0.1mol SO3,相当于起始加入了0.3molSO2和0.15molO2,减少反应物二氧化硫的量,增加氧气;
B、放入0.2mol SO2、0.1molO2、0.2mol SO3,相当于在原平衡基础上增加了0.1molO2,平衡正向进行;
C、放入0.4mol SO2、0.1molO2,与原平衡完全等效;
D、放入0.2mol SO2、0.1molO2,相当于在原平衡基础上减少了0.2molSO2,减少反应物二氧化硫的量,平衡逆向进行.
解答 解:A、放入0.2mol SO2、0.1molO2、0.1mol SO3,相当于起始加入了0.3molSO2和0.15molO2,减少反应物二氧化硫的量,增加氧气,平衡移动不确定,要根据浓度积和平衡常数判断,故A错误;
B、放入0.2mol SO2、0.1molO2、0.2mol SO3,相当于在原平衡基础上增加了0.1molO2,平衡正向进行,则平衡时SO3必大于amol,故B正确;
C、放入0.4mol SO2、0.1molO2,与原平衡完全等效,达到平衡时SO3会等于amol,故C错误;
D、放入0.2mol SO2、0.1molO2,相当于在原平衡基础上减少了0.2molSO2,减少反应物二氧化硫的量,平衡逆向进行,则达到平衡时SO3必小于amol,故D正确.
故选BD.
点评 本题考查了可逆反应,要注意用化学平衡中的等效平衡的判断方法,明确极限转化后起始量的大小是解答的关键.


科目:高中化学 来源: 题型:选择题
| A. | 固体中阳离子和阴离子个数不一定相等 | |
| B. | 固体中一定有离子键可能有共价键 | |
| C. | 若X只含两种元素,所含元素一定不在同一周期也不在同一主族 | |
| D. | 固体中阳离子半径一定大于阴离子半径 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 采取低碳、节俭的生活方式,深入农村和社区宣传环保知识 | |
| B. | 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同 | |
| C. | 热纯碱可以去油污,明矾可以净化水,漂白粉可用于漂白织物 | |
| D. | 海水淡化的方法有蒸馏法、电渗析法等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养.
化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a≥b | B. | a≤b | C. | a>b | D. | a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
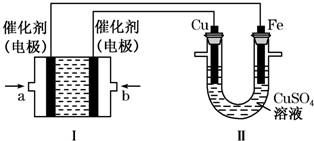
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com