
完全中和50ml物质的量浓度为2mol/LnaOH
溶液需要H2SO4的质量是多少?若将这些H2SO4溶于水配成500ml溶液,求H2SO4的物质的量浓度是多少?
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E的+1价阳离子的核外有3层电子且各层均处于全满状态。
(1)E元素基态原子的核外电子排布式为__________________________ ______________________________________________。
(2)B、C、D三种元素的第一电离能由小到大的顺序为________(填元素符号),其原因是__________________________________________ ______________________________。
(3)B2A4是石油炼制的重要产物之一 。B2A4分子中B原子轨道的杂化类型为________;1 mol B2A2分子中含________mol σ键。
(4)已知D、E能形成晶胞结构如图所示的两种化合物,则化学式:甲为____________________,乙为______________________;高温时,甲易转化为乙的原因为______________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
在稀硫酸与锌反应制取氢气的实验中,探究加人硫酸铜
溶液的量对氢气生成速率的影响。实验中Zn粒过量且颗粒大小相同,饱和硫酸铜溶液用量0一4. 0mL,保
持溶液总体积为100. 0mL,记录获得相同体积(336 mL,)的气体所需时间,实验结果如图所示(气体体积均转
化为标况下)。据图分析,下列说法不正确的是

A.饱和硫酸铜溶液用量过多不利于更快收集氢气
B.a ,c两点对应的氢气生成速率相等
C.b点对应的反应速率为v( H2SO4)=1.0x10-3mol·L -1 ·s-1
D.d点没有构成原电池,反应速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
用单位质量的溶剂中所含溶质的物质的量来表示的溶液浓度叫做质量物质的量浓度,其单位为mol/kg,若5 mol/kg的H2SO4溶液的密度为1.30 g/mL,则它的物质的量浓度为  ( )
( )
A.3.56 mol/L B.4.36 mol/L C.5.00 mol/L D.5.25 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
在V mL Al2(SO4)3溶液中含有Al3+m g,取V/4 mL该溶液用水稀释至4V mL,则SO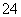 物质的量浓度为 ( )
物质的量浓度为 ( )
A.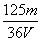 mol/L B.
mol/L B.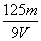 mol/L C.
mol/L C.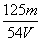 mol/L D.
mol/L D.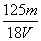 mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
用固体NaOH配制250 mL 0.5 mol·L-1NaOH溶液;
(1)在下列仪器中:①托盘天平(带砝码);②量筒;③烧杯;④玻璃棒;⑤漏斗;⑥500 mL容量瓶;⑦药匙;⑧250 mL容量瓶;⑨胶头滴管;⑩坩埚。
A.配制过程中必须用到的仪器有:___________________________(填写代号)。
B.容量瓶使用前应__________,中学化学实验常用仪器中使用前和容量瓶使用有相同操作的不同类玻璃仪器还有:________、________;
(2)下列操作使所配制的NaOH溶液浓度偏高的有:________(填写代号)。
①称取固体NaOH时未用小烧杯
②没有用水冲洗烧杯2~3次
③定容时,俯视液面使之与刻度相切
④溶液配好摇匀后,发现液面低于刻度线,又加水至液面与刻度相切
⑤将未冷却的溶液注入容量瓶后,马上定容
⑥样品中混有Na2O杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
某乙醇水溶液的质量分数为w%,物质的量浓度为cmol/L ,密度为dg/mL,1Kg这种溶液中含有的乙醇是:
,密度为dg/mL,1Kg这种溶液中含有的乙醇是:
A.46C g B.c/d mol C.c mol D.1000dw g
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质分类正确的是
A.SO2、SiO2、 CO均为酸性氧化物
B.稀豆浆、硅酸、氯化铁溶液均为胶体
C.烧碱、冰醋酸、四氯化碳均为电解质
D.福尔马林、水玻璃、氨水均为混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
温度为t ℃ 时,在体积为10 L的真空容器中通入1.00 mol氢气和1.00 mol碘蒸气,20 min后,反应达到平衡,此时测得碘蒸气的浓度为0.020 mol·L-1。涉及的反应可以用下面的两个化学方程式表示:
时,在体积为10 L的真空容器中通入1.00 mol氢气和1.00 mol碘蒸气,20 min后,反应达到平衡,此时测得碘蒸气的浓度为0.020 mol·L-1。涉及的反应可以用下面的两个化学方程式表示:
①H2(g)+I2(g)  2HI(g)
2HI(g)
②2H2(g)+2I2(g)  4HI(g)
4HI(g)
下列说法正确的是 ( )
A.反应速率用HI表示时,v(HI)=0.008 mol·L-1·min-1
B.两个化学方程式的意义相同,但其平衡常数表达式不同,不过计算所得数值相同
C.氢气在两个反应方程式中的转化率不同
D.第二个反应中,增大压强平衡向生成HI的方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com