
| A. | ①②③④ | B. | ①②③ | C. | ①② | D. | ①③ |
分析 ①钠和氧气反应因为条件不同导致其产物不同;
②氯化铝和氨水反应生成氢氧化铝,与氨水的量无关;
③纯碱溶液与稀盐酸,当盐酸过量生成二氧化碳或少量时生成的碳酸氢钠不同;
④铁在氯气中燃烧都生成氯化铁,与氯气量的多少无关.
解答 解:①在没有条件的条件下,钠和氧气反应生成氧化钠,在加热条件下,钠燃烧生成过氧化钠,故正确;
②氯化铝和氨水反应时,无论氨水是否过量都生成氢氧化铝沉淀,故错误;
③纯碱溶液与稀盐酸,当盐酸过量生成二氧化碳或少量时生成的碳酸氢钠不同,故正确;
④在点燃条件下,铁和氯气反应都生成氯化铁,与氯气的量无关,故错误;
故选D.
点评 本题考查了物质之间的反应,有的反应与反应物的用量、反应物浓度、反应条件不同而导致产物不同,注意氢氧化铝不溶于氨水,为易错点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁发生析氢腐蚀时,0.56gFe反应 转移电子数为0.03NA | |
| B. | 1L 0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| C. | 1molH2O2分子中的非极性共价键 1NA | |
| D. | 氢氧燃料电池正极消耗22.4L气体时,电路中通过的电子数目为4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
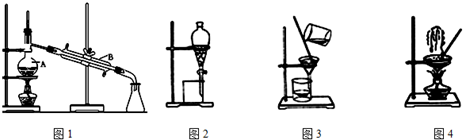
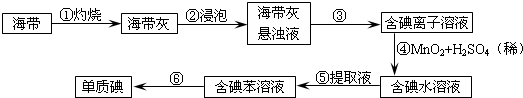
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①③ | C. | ②④ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
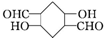 )
)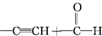 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$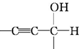
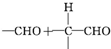 $\stackrel{稀NaOH}{→}$
$\stackrel{稀NaOH}{→}$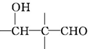
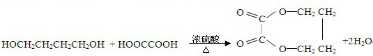 (注明条件).
(注明条件).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.
已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 混合物:漂白粉、福尔马林、水玻璃 | B. | 化合物:CaCl2、烧碱、HD | ||
| C. | 电解质:明矾、HCl、硫酸钡 | D. | 纯净物:干冰、冰水混合物、红宝石 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
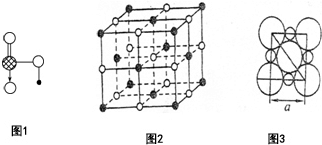 (1)Na、Cu、Si、H、C、N六种元素,其对应单质的熔点按照A、B、C、D、E、F的顺序依次升高,其中C、D均是热和电的良导体.
(1)Na、Cu、Si、H、C、N六种元素,其对应单质的熔点按照A、B、C、D、E、F的顺序依次升高,其中C、D均是热和电的良导体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com