
【题目】已知化学反应的热效应只与反应物的初始状态和生成物的最终状态有关,下列各反应热关系中不正确的是( )

A. A→F ΔH=-ΔH6
B. A→D ΔH=ΔH1+ΔH2+ΔH3
C. ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0
D. ΔH1+ΔH6=ΔH2+ΔH3+ΔH4+ΔH5
【答案】D
【解析】
根据盖斯定律可知只要反应物和生成物确定,无论经过怎样的途径反应热都相等,如果反应物和生成物互换则反应热互为相反数。
A.反应物和生成物互换那么反应热互为相反数,F→A ΔH=ΔH6,所以 A→F ΔH=-ΔH6,故A正确;
B. 根据盖斯定律可知只要反应物和生成物确定,无论经过怎样的途径反应热都相等,所以A→D ΔH=ΔH1+ΔH2+ΔH3,故B正确;
C. A→A 焓变为0,所以ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0,故C正确;
D.F→B ΔH=ΔH1+ΔH6, B→F ΔH =ΔH2+ΔH3+ΔH4+ΔH5,所以ΔH1+ΔH6=-(ΔH2+ΔH3+ΔH4+ΔH5),故D错误。选D。


科目:高中化学 来源: 题型:
【题目】下图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:


图Ⅲ 铜晶体中铜原子堆积模型
(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为________________,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为__________________________________。
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是________,H3BO3晶体中B原子个数与极性键个数比为____________。
(3)金属铜具有很好的延展性、导电性、传热性,对此现象最简单的解释是用________理论。
(4)三种晶体中熔点最低的是________(填化学式),其晶体受热熔化时,克服的微粒之间的相互作用为____________________________________________________________。
(5)已知两个距离最近的Ca2+核间距离为a×10-8cm,结合CaF2晶体的晶胞示意图,CaF2晶体的密度为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究物质结构与性质之间的关系和元素性质的递变规律,设计了如下系列实验。回答下列问题:
I.NaNH2熔点(210℃)比NaOH 熔点(318.4℃)低, 解释原因正确的是 (__________)
A.是因为NaNH2比NaOH 的相对分子质量小,前者分子间作用力小。
B.NaOH存在分子间氢键
C.NaNH2、NaOH均是离子化合物,其熔沸点高低与离子键的强弱有关,阴、阳离子电荷数越高,离子半径越小,离子键强度越大(或离子晶体的晶格能越大),则熔点越高。由于原子半径N>O,且NH2- 比OH- 原子个数多,则NH2- 比OH- 离子半径大,所以NaNH2比NaOH离子晶体的晶格能小,其熔点低。
D.N和O均处于第二周期,N在左方,同周期元素从左到右,元素的非金属性增强,其氢化物水溶液的酸性H2O>NH3,则碱性NaNH2>NaOH
II.根据下图所示装置回答以下问题。
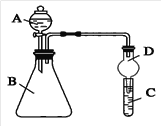
(1)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证Cl的非金属性大于S:锥形瓶中发生反应的离子方程式为_________________________。试管中的实验现象为___________________________。
(2)若要用此装置证明非金属性: N>C>Si,从以下所给物质中选出实验所要用到物质:
①稀HNO3溶液 ②稀硫酸溶液 ③碳酸钙 ④Na2SiO3溶液 ⑤SiO2
试剂A与C分别对应为_________________(填数字序号)。
有同学认为此实验不能说明N、C、Si的非金属性强弱,你认为发生干扰的化学方程式为:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为严厉打击食品生产经营中违法添加非食用物质、滥用食品添加剂,卫生部、农业部等部门联合公布了包含硫酸亚铁在内的22种“易滥用食品添加剂”名单。某同学为探究富含硫酸亚铁且保存时间较长的食品情况,设计了如下实验方案:
![]()
(1)试剂1的主要成分的化学式是________。
(2)加入新制氯水后溶液红色加深的原因是_____________(用离子方程式表示)。
(3)该同学在实验中加入了过量氯水,放置一段时间后,发现深红色褪去,现对褪色原因进行探究。
①提出假设
假设1:溶液中的+3价铁被氧化为更高价态的铁;
假设2:___________。
②设计方案
为了对你所提出的假设2进行验证,请写出一种实验方案:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)甲醛的电子式:____________________。
(2)2,5-二甲基-2,4-己二烯的结构简式______________________________。
(3)![]() 的键线式为________________________。
的键线式为________________________。
(4)写出分子式为C4H9Cl的所有同分异构体中核磁共振氢谱只有一组峰的结构简式_______________。
(5)![]() 中含氧官能团的名称是______________________。
中含氧官能团的名称是______________________。
(6)用系统命名法命名下列有机物:
①![]() ______________________。
______________________。
②![]() ______________________。
______________________。
③![]() ______________________。
______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是铁棒和碳棒在稀硫酸中所组成的原电池装置,c、d为两个电极。下列有关的判断正确的是

A.电池工作的过程中,c电极上产生气泡
B.电池工作时,溶液中H+和Fe2+向d移动
C.d为负极,发生氧化反应
D.电池工作的过程中,溶液中SO![]() 浓度发生显著变化
浓度发生显著变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填写下列空白:
(1)写出表示含有8个质子、10个中子的原子的化学符号:__________。
(2)周期表中最活泼的非金属元素位于第__________纵行。
(3)周期表中位于第4周期、ⅡA族的元素符号是:___________ 。
(4)所含元素为18种的周期是第_________周期、第________周期。
(5)写出第2周期、ⅤA族元素单质的电子式:______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向一定体积的0.1mol·L-1的Na2CO3溶液中逐滴加入0.1mol·L-1盐酸至过量,溶液中含碳元素的各微粒的物质的量浓度的百分含量随溶液pH的变化如图所示(CO2因逸出未画出,滴加盐酸的过程中温度的变化忽略不计)。下列说法正确的是
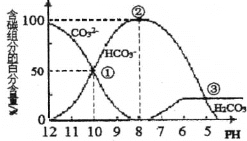
A. 由图可知,碳酸的-lgKa2=10
B. 点②所示溶液中:c(HCO3-)=0.1mol·L-1
C. 当滴加盐酸到点③时,才开始放出CO2气体
D. Na2CO3第一步水解反应的平衡常数:①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为探究SO2和Fe(NO3)3溶液的反应的实质。设计了如下图所示装置进行实验.
已知:1.0 mol/L的Fe(NO3)3溶液的pH=1。

请回答:
(1)装置A中用于添加浓硫酸的仪器名称为__________________。
(2)实验前鼓入N2的目的是________________________________。
(3)装置B中产生了白色沉淀,其成分是________,说明SO2具有________性。
(4)分析B中产生白色沉淀的原因。
观点1:SO2与Fe3+反应;
观点2:在酸性条件下SO2与NO3-反应;
①若观点1正确,除产生沉淀外,还应观察到的现象是_________________。
②按观点2,装置B中反应的离子方程式是______________________________,
③有人认为,如将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验,也可验证观点2是否正确。此时应选择的最佳试剂是(填序号)_____。
A.1 mol/L稀硝酸 |
B.1.5 mol/L Fe(NO3)2溶液 |
C.6.0 mol/L NaNO3溶液和0.2 mol/L盐酸等体积混合的溶液 |
D.3.0 mol/L NaNO3溶液和0.1mol/L硫酸等体积混合的溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com