
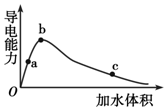
 一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )
一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )| A. | 醋酸的电离程度:a<b<c | |
| B. | 溶液的pH值:b>a>c | |
| C. | 蘸取c点溶液滴在湿润的pH试纸上,测得pH值一定偏大 | |
| D. | 若分别向a、b、c三点的溶液中,加入同浓度的氢氧化钠溶液中和,消耗NaOH溶液的体积a=b=c |
分析 醋酸为弱电解,浓度越小,电离程度越大,对于该溶液,电离程度反应了氢离子的浓度,溶液导电能力越大,离子浓度越大,结合溶液的电荷守恒分析.
解答 解:A.醋酸为弱电解质,加水促进电离,浓度越小,电离程度越大,则乙酸的电离程度:a<b<c,故A正确;
B.电离程度反映了氢离子的浓度,溶液导电能力越大,离子浓度越大,氢离子浓度越大,pH越小,溶液的pH值:c>a>b,故B错误;
C、由图象可看出,c点稀释导电能力最弱,则蘸取c点溶液滴在湿润的pH试纸上,溶液被稀释测得pH值变大,故C正确;
D、a、b、c三点溶液浓度不同,但溶质的物质的量相同,所以a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:a=b=c,故D正确;
故选B.
点评 本题考查弱电解质的电离,题目难度不大,注意把握弱电解质的电离特点,注意导电能力与离子浓度大小有关.


科目:高中化学 来源: 题型:选择题
| A. | FeCl3=Fe2++3Cl- | B. | NaOH=Na++OH- | ||
| C. | H2SO4=H2++SO42- | D. | NaHCO3=Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (SCN)2+2NaOH→NaSCN+NaSCNO+H2O | B. | (SCN)2+2NaBr→Br2+2NaSCN | ||
| C. | 4HSCN+MnO2→Mn(SCN)2+(SCN)2+2H2O | D. | (SCN)2+2KI→2KSCN+I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | F-、I-、S2- | B. | Fe3+、MnO4-、HNO2 | C. | ClO-、Mg、H2O2 | D. | Cl2、Fe2+、Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
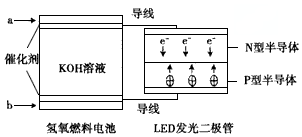
| A. | 电池负极电极反应式为H2-2e-+2OH-=2H2O | |
| B. | a处通入氧气,b处通入氢气 | |
| C. | 该装置中能量转化只涉及两种形式的能量 | |
| D. | P一型半导体连接的是电池负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子 | 要求 |
| A | K+、Cl-、SO42-、MnO4- | c(K+)<c(Cl-) |
| B | Na+、Ca2+、I-、NO3- | c(H+)/c(OH-)=1×1014 |
| C | Al3+、NH4+、SO42-、CH3COO- | 滴加NaOH浓溶液立刻有气体产生 |
| D | Na+、HCO3-、Cl-、SO42- | 滴加Al2(SO4)3溶液立刻有沉淀和气体产生 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe+H2SO4=FeSO4+H2↑ | B. | CaCO3$\frac{\underline{\;\;△\;\;}}{\;}$CaO+CO2↑ | ||
| C. | CO2+C$\frac{\underline{\;\;△\;\;}}{\;}$2CO | D. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将1〜2滴浓硫酸滴入紫色石蕊试液中,溶液先变红后变黑 | |
| B. | 浓硫酸因为具有吸水性,所以可以使蔗糖炭化 | |
| C. | 浓硫酸和Na2SO3反应制取SO2时,浓硫酸表现出强氧化性 | |
| D. | 浓硫酸和铜片在加热条件下反应时,浓硫酸既表现出酸性,又表现出强氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com